வேதிப்பிணைப்பு Notes 9th Science Lesson 13 Notes in Tamil
வேதிப்பிணைப்பு Notes 9th Science Lesson 13 Notes in Tamil
அறிமுகம்
- பருப்பொருளின் கட்டமைப்புக் கூறுகள் அணுக்கள் என்பதை நாம் ஏற்கனவே அறிவோம். மந்தவாயு அணுக்களைத்தவிர , மற்ற அணுக்கள் சாதாரண நிலையில் இயற்கையில் தனித்துக் காணப்படுவதில்லை. எனினும், ஒரு குழுவாக அணுக்கள் இணைந்து ஒரே பொருளாகக் காணப்படுகின்றன. இவ்வாறு அணுக்களால் இணைக்கப்பட்ட தொகுதியே மூலக்கூறு எனப்படுகிறது.
- ஒரு பூமாலையில் உள்ள பூக்கள் நூலினால் பிணைக்கப்பட்டிருப்பதைப் போல, மூலக்கூறில் உள்ள அணுக்களும் குறிப்பிட்ட கவர்ச்சி விசையினால் இணைக்கப்பட்டிருக்க வேண்டும் என்பது தெளிவாகிறது. அணுக்களை இணைக்கும் இக்கவர்ச்சி விசையே வேதிப்பிணைப்பு எனப்படுகிறது.


- வேதிப்பிணைப்பு என்பதை ஒரு மூலக்கூறில் உள்ள அணுக்களை ஒன்றாக சேர்த்து, பிணைத்து வைக்கும் கவர்ச்சி விசை என வரையறுக்கலாம். இப்பாடத்தில் வேதிப்பிணைப்பு பற்றிய கோசல்-லூயிஸ் கொள்கை, லூயிஸ் புள்ளி அமைப்பு மற்றும் வேதிவினைகளின் வகைகளைப் பற்றி காண்போம்.
வேதிப்பிணைப்பு பற்றிய கோசல் –லூயிஸ் கொள்கை
எட்டு எலக்ட்ரான் விதி
பலதரப்பட்ட தனிமங்களின் அணுக்கள் பல்வேறு வகையில் இணைந்து வேதிச்சேர்மங்களை உருவாக்குகின்றன. இந்நிகழ்வு பல வினாக்களை எழுப்பியது.
- ஏன் அணுக்கள் இணைகின்றன?
- அணுக்கள் எவ்வாறு இணைகின்றன?
- ஏன் ஒரு சில அணுக்கள் இணைகின்றன; மற்றவை இணைவதில்லை?
இதுபோன்ற வினாக்களுக்கு விடையளிக்கும் வகையில் பல்வேறு கொள்கைகள் முன் மொழியப்பட்டன. அவற்றுள் முக்கியமான ஒன்று மூலக்கூறுகள் எவ்வாறு உருவாகின்றன என்பதை விளக்கும் கோசல்-லூயிஸ் கொள்கை ஆகும்.
- மந்தவாயு எலக்ட்ரான் அமைப்பு என்ற கருத்தை அடிப்படையாகக் கொண்டு ஏன் அணுக்கள் இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன என்பதனை கோசல் மற்றும் லூயிஸ் விளக்கினர்.
- மந்த வாயு அணுக்கள் தங்களுக்கிடையிலோ அல்லது மற்ற அணுக்களுடனோ எளிதில் இணைவதில்லை அல்லது அரிதாக இணைகின்றன. அவை ஒரு நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதையே இது காட்டுகிறது. அட்டவணையில் மந்த வாயுக்களின் எலக்ட்ரான் அமைப்புகள் கொடுக்கப்பட்டுள்ளன.
மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பு
| தனிமத்தின் பெயர் | அணு எண் | கூடு எலக்ட்ரான் அமைப்பு |
| ஹீலியம் (He) | 2 | 2 |
| நியான் (Ne) | 10 | 2, 8 |
| ஆர்கான் (Ar) | 18 | 2, 8, 8 |
| கிரிப்டான் (Kr) | 36 | 2, 8, 18, 8 |
| செனான் (Xe) | 54 | 2, 8, 18, 18, 8 |
| ரேடான் (Rn) | 86 | 2, 8, 18, 32, 18, 8 |
- ஹீலியத்தைத் தவிர, மற்ற மந்த வாயுக்கள் அனைத்தும் அவற்றின் இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான்களைப் பெற்றிருக்கின்றன. ஹீலியம் அணுவும் முழுவதும் நிரம்பிய இணைதிறன் கூட்டைப் பெற்றிருப்பதால், அதில் மேலும் எலக்ட்ரான்களைச் சேர்க்க இயலாது.
- இவ்வாறாக, மந்த வாயு அணுக்கள் இணைதிறன் கூட்டில் நிலையான எலக்ட்ரான் அமைப்பைப் பெற்றிருப்பதால் அவை எலக்ட்ரான்களை இழக்கும் அல்லது ஏற்கும் தன்மையைப் பெற்றிருப்பதில்லை. எனவே, அவற்றின் இணைதிறன் பூச்சியமாகும்.
- மிகவும் மந்தத் தன்மையைக் கொண்டிருப்பதால், அவை ஈரணு மூலக்கூறுகளைக் கூட உருவாக்குவதில்லை. ஆகவே அவை ஓரணு வாயுக்களாகவே காணப்படுகின்றன.
- மந்த வாயு எலக்ட்ரான் அமைப்பை அடிப்படையாகக் கொண்டு, 1916ஆம் ஆண்டில் கோசல் மற்றும் லூயிஸ் என்பார் அணுக்களின் வேதிச்சேர்க்கைகளுக்கான கொள்கையை முன்மொழிந்தனர். இதுவே இணைதிறன் எலக்ட்ரான் கொள்கை அல்லது எட்டு எலக்ட்ரான் விதி எனப்படுகிறது. இக்கொள்கைப்படி, மந்த வாயுக்கள் தவிர, மற்ற தனிமங்களின் அணுக்கள் முழுவதும் நிரப்பப்படாத இணைதிறன் கூட்டைப் பெற்றிருக்கின்றன. எனவே, மந்த வாயுக்கள் போன்று நிலையான எலக்ட்ரான் அமைப்பைப் பெறுவதற்காக அவை மற்ற அணுக்களுடன் இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன.
- ஒரு அணு அதன் இணைதிறன் கூட்டில் உள்ள எலக்ட்ரான்களை மற்றொரு அணுவிடம் இழந்தோ அல்லது பங்கீடு செய்தோ இணைவதன் மூலம் நிலையான மந்த வாயு எலக்ட்ரான் அமைப்பைப் பெறுகிறது.
- ஒரு அணுவானது மற்றொரு அணுவிடம் அதன் இணைதிறன் கூடு எலக்ய்ட்ரான்களை இழந்தோ அல்லது பங்கீடு செய்தோ இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான்களைப் பெற்றிருக்கும் விளைவு “எட்டு எலக்ட்ரான்விதி” அல்லது “எண்ம விதி” எனப்படுகிறது.
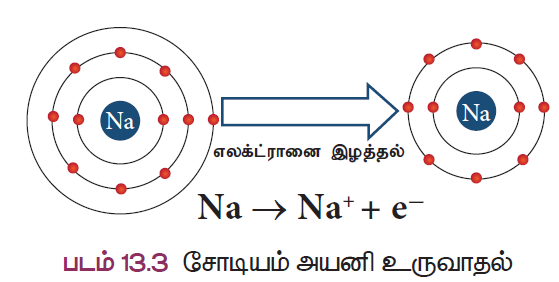
- உதாரணமாக, சோடியத்தின் அணு எண் 11. சோடியம் அதன் இணைதிறன் கூட்டிலிருந்து ஒர்ய் எலக்ட்ரானை எளிதில் இழந்து நியான் அணுவின் எலக்ட்ரான் அமைப்பைப் பெறுகிறது (படம் 13.3).
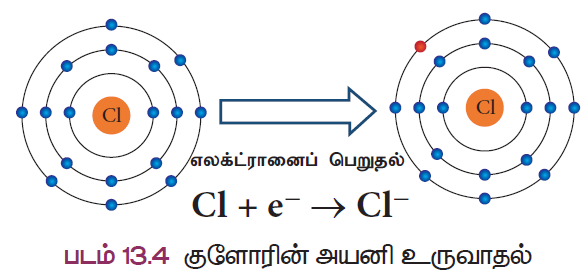
- அதைப்போலவே, குளோரின் அணுவின் எலக்ட்ரான் அமைப்பு 2, 8, 7. இஹற்கு நெருக்கமான மட்ந்ஹ வாயுவான ஆர்கானின் எலக்ட்ரான் அமைப்பைப் பெற குளோரினுக்கு மேலும் ஓர் எலக்ட்ரான் தேவைப்படுகிறது. எனவே, குளோரின் அணு மற்றொரு அணுவிடமிருந்து ஓர் எலக்ட்ரானை எளிதில் பெற்று நிலையான ஆர்கான் எலக்ட்ரான் அமைப்பைப் பெறுகிறது (படம் 13.4).
- இவ்வாறாக, தனிமங்கள் எலக்ட்ரான்களை இழந்தோ அல்லது ஏற்றோ நிலையான இணைதிறன் கூட்டினைப் (எட்டு எலக்ட்ரான்கள்) பெறுகின்றன.
எவ்வகை அணுக்கள் எலக்ட்ரான்களை இழக்க வல்லவை? எவ்வகை அணுக்கள் எலக்ட்ரான்களை ஏற்க வல்லவை? இணைதிறன் கூட்டில் தலா 1, 2, 3 எலக்ட்ரான்களைப் பெற்றிருக்கும் அணுக்கள் எலக்ட்ரான்களை இழக்க வல்லவை. மாறாக, இணைதிறன் கூட்டில் தலா 5,6,7 எலக்ட்ரான்களைக் கொண்ட அணுக்கள் எலக்ட்ரான்களை ஏற்கும் தன்மையுடையவை.
நிலையற்ற மின்னணு கட்டமைப்பு
| தனிமம் | அணு எண் | எலக்ட்ரான் அமைப்பு | இணைதிறன் எலக்ட்ரான்கள் |
| போரான் | 5 | 2, 3 | 3 |
| நைட்ரஜன் | 7 | 2, 5 | 5 |
| ஆக்சிஜன் | 8 | 2, 6 | 6 |
| சோடியம் | 11 | 2, 8, 1 | 1 |
- ஒரு உலோகத்தின் இணைதிறன் என்பது அந்த உலோகம் இழக்கும் எலக்ட்ரான்களின் எண்ணிக்கை ஆகும். ஒரு அலோகத்தின் இணைதிறன் என்பது அது ஏற்கும் எலக்ட்ரான்களின் எண்ணிக்கை ஆகும்.
லூயிஸ் புள்ளி அமைப்பு
- அணுக்கள் இணைந்து சேர்மங்கள் உருவாகும்போது அணுக்களின் இணைதிறன் எலக்ட்ரான்கள் பிணைப்பில் ஈடுபடுகின்றன. ஆகவே, இணைதிறன் எலக்ட்ரான் அமைப்பிற்கான குறியிடும் முறை ஒன்றைப் பெறுவது உதவிகரமாக இருக்கும். இதனை லூயிஸ் புள்ளி அமைப்பைக் கொண்டு செய்ய இயலும்.
- ஒரு அணுவின் குறியீட்டைச் சுற்று அவ்வணுவின் இணைதிறன் கூடு எலக்ட்ரான்களை புள்ளிகளாகக் குறிக்கும் அமைப்பே லூயிஸ் புள்ளி அமைப்பு அல்லது எலக்ட்ரான் புள்ளி அமைப்பு எனப்படும்.
- இணைதிறன் கூட்டில் உள்ள இணையாகாத எலக்ட்ரான் ஒற்றைப் புள்ளியாகவும், ஜோடியான எலக்ட்ரான்கள் ஜோடிப்புள்ளிகளாகவும் குறிக்கப்படுகின்றன.
- மூலக்கூறில் உள்ள வெவ்வேறு தனிமங்களின் எலக்ட்ரான்களைக் குறிப்பதற்கு புள்ளிகளைத் தவிர வட்ட அல்லது குறுக்குக் குறியீடு பயணப்படுத்தப்படுகின்றன.
லூயிஸ் புள்ளி அமைப்பு
| தனிமம் | அணு எண் | எலக்ட்ரான் அமைப்பு | இணைதிறன் எலக்ட்ரான்கள் | லூயிஸ் புள்ளி அமைப்பு |
| ஹைட்ரஜன் | 1 | 1 | 1 | |
| ஹீலியம் | 2 | 2 | 2 | |
| பெரிலியம் | 4 | 2, 2 | 4 | |
| கார்பன் | 6 | 2, 4 | 4 | |
| நைட்ரஜன் | 7 | 2, 5 | 5 | |
| ஆக்ஸிஜன் | 8 | 2, 6 | 6 |
- அணுவின் குறியீட்டைச் சுற்றி நான்கு பக்கங்களிலும் ஒவ்வொரு புள்ளிகளாக முதலில் குறிக்கப்படுகின்றன. பிறகு ஒரு பக்கத்திற்கு இரண்டு வீதம் இணைதிறன் எலக்ட்ரான்கள் முழுவதும் புள்ளிகளாக குறிக்கப்படுகின்றன. ஒற்றைப் புள்ளியை எந்தப் பக்கத்திலும் குறிக்கலாம்.
வேதிப்பிணைப்பின் வகைகள்
- அனைத்துத் தனிமங்களும் அவற்றின் இணைதிறன் எலக்ட்ரான் அமைப்பைப் பொறுத்து வேறுபடுகின்றன. எனவே அவை ஒன்றுடன் ஒன்று இணைந்து சேர்மங்களை உருவாக்கும் விதமும் வேறுபடுகின்றது.
- இவ்வாறாக, அணுக்கள் இணைந்து மூலக்கூறாக மாறும்போது அவற்றிற்கிடையே பல்வேறு வகையான வேதிப்பிணைப்புகள் உருவாக வாயுப்பு உள்ளது. ஒரு மூலக்கூறில் உள்ள அவ்வகையான பிணைப்புகள் கீழ்க்கண்டவாறு வகைப்படுத்தப்படுகின்றன (படம் 13.5).
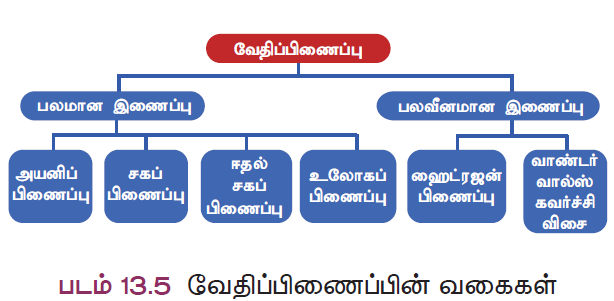
- மேற்கண்டவற்றில், அயனிப்பிணைப்பு, சகப்பிணைப்பு மற்றும் ஈதல் சகப்பிணைப்பு பற்றி இப்பாடத்தில் காண்போம். மற்ற பிணைப்புகள் பற்றி உயர் வகுப்பில் காணலாம்.
அயனிப்பிணைப்பு
- அயனிப்பிணைப்பு என்பது ஒரு நேர்மின் அயனிக்கும், எதிர்மின் அயனிக்கும் இடையே நிலைமின் ஈர்ப்பு விசையால் ஏற்படும் பிணைப்பு ஆகும்.
- ஒரு அணுவின் இணைதிறன் கூட்டிலிருந்து ஒன்றோ அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களோ மற்றொரு அணுவின் இணைதிறன் கூட்டிற்கு மாற்றப்படும்போது இப்பிணைப்பானது உருவாகிறது. இதில் எலக்ட்ரானை இழக்கும் அணு நேர்மின் அயனியையும் உருவாக்குகின்றன.
- எதிரெதிர் மின்சுமையுள்ள இந்த இரண்டு அயனிகளும் ஒன்றையின்று நெருங்கும்போது நிலைமின் கவர்ச்சிவிசைக்குட்பட்டு அயனிப் பிணைப்பை உருவாக்குகின்றன.
- இப்பிணைப்பு இரு அயனிகளுக்கிடையே உருவாவதால் அயனிப் பிணைப்பு எனவும், அயனிகள் நிலைமின் ஈர்ப்பு விசையால் இணைக்கப்படுவதால் நிலை மின் பிணைப்பு எனவும் அழைக்கப்படுகிறது. மேலும், இணைதிறன் கொள்கை எலக்ட்ரான்களை அடிப்படையாகக் கொண்டு விளக்கப்படுவதால் இது எலக்ட்ரான் இணைதிறன் பிணைப்பு எனவும் அழைக்கப்படுகிறது.
- ஒரு தனிமத்தின் அணு எலக்ட்ரானிய இணைதிறன் பிணைப்பை உருவாக்கும்போது அவ்வணு இழக்கும் அல்லது ஏற்கும் எலக்ட்ரான்களின் எண்ணிக்கை அதன் எலக்ட்ரான் இணைதிறன் எனப்படுகிறது.
அயனிப்பிணைப்பு உருவாதல்
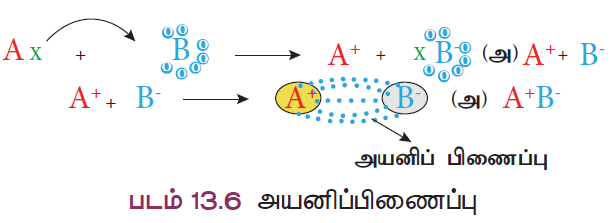
- A மற்றும் B என்ற இரு அணுக்களைக் கருதுவோம். நிலையான எட்டு எலக்ட்ரான் அமைப்பை விட A அணுவில் ஒரு எலக்ட்ரான் கூடுதலாகவும், B அணுவில் ஒரு எலக்ட்ரான் குறைவாகவும் இருப்பதாகக் கொள்வோம்.
- அணு A ஒரு எலக்ட்ரானை அணு Bக்கு பரிமாறும் போது இரு அணுக்களும் நிலையான “எட்டு எலக்ட்ரான்” அமைப்பைப் பெறுகின்றன. இந்த எலக்ட்ரான் பரிமாற்றத்தால், அணு A நேர்மின் அயனியாகவும், அணு B எதிர்மின் அயனியாகவும் மாறுகின்றன. எதிரெதிர் மின்சுமை உள்ள இவ்விரு அயனிகளுக்கிடையே உருவாகும் நிலைமின் கவர்ச்சி விசையானது அயனிகளைப் பிணைக்கிறது. இதுவே அயனிப்பிணைப்பு எனப்படுகிறது.
- பொதுவாக, அயனிப்பிணைப்பு ஒரு உலோகத்திற்கும் அலோகத்திற்கும் இடையே உருவாகிறது. இவ்வாறு அயனிப்பிணைப்பைக் கொண்ட சேர்மங்கள் அயனிச்சேர்மங்கள் எனப்படுகின்றன. தனிம அட்டவணையில் முதல் தொகுதி தனிமங்கள், அதாவது, கார உலோகங்கள் அலோகங்களுடன் வினை புரிந்து அயனிச்சேர்மங்களை உருவாக்குகின்றன.
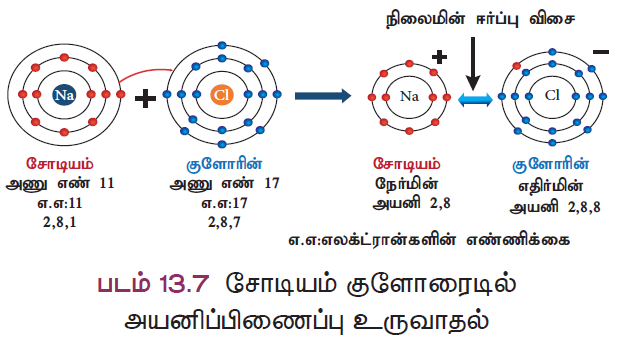
விளக்கம் 1: சோடியம் குளோரைடு (NaCl) உருவாதல்
சோடியத்தின் அணுஎண் 11 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2, 8, 1 ஆகும். சோடியம் அதற்கு நெருக்கமான மந்த வாயுவான நியானை விட ஒரு எலக்ட்ரான் கூடுதலாகப் பெற்றிருக்கிறது. எனவே சோடியம் ஒரு எலக்ட்ரானை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக் கொண்ட சோடியம் அயனியாக (Na+) மாறவல்லது.
குளோரினின் அணுஎண் 17 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2, 8, 7 ஆகும். குளோரின் அதற்கு அருகே உள்ள (தனிம அட்டவணையில்) மந்த வாயுவான ஆர்கானை விட ஒரு எலக்ட்ரான் குறைவாகப் பெற்றுள்ளது. எனவே, குளோரின் நிலையான எலக்ட்ரான் அமைப்பைப் பெறும் வகையில் ஒரு எலக்ட்ரானை ஏற்று குளோரைடு அயனியாக (Cl–) மாற வல்லது.
எனவே, சோடியம் மற்றும் குளோரின் அணுக்கள் ஈணையும்போது, சோடியம் அணுவிலிருந்து ஒரு எலக்ட்ரான் குளோரின் அணுவிற்கு பரிமாற்றம் செய்யப்பட்டு சோடியம் குளோரைடு மூலக்கூறு உருவாகிறது. இதன் மூலம் இரு அணுக்களும் நிலையான “எட்டு எலக்ட்ரான்” அமைப்பைப் பெறுகின்றன (படம் 13.7).
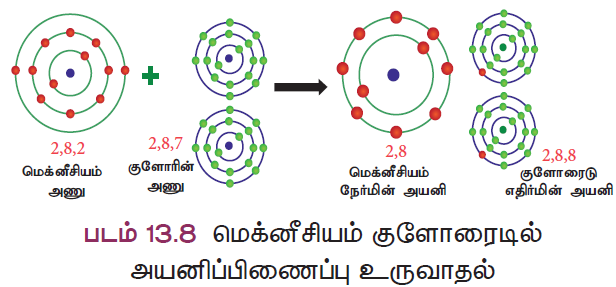
விளக்கம் 2: மக்னீசியம் குளோரைடு (MgCl2) உருவாதல்
மெக்னீசியத்தின் அணு எண் 12 மற்றும் அதன் எலக்ட்ரான் அமைப்பு 2, 8, 2 ஆகும். மக்னீசியம் அதற்கு நெருக்கமான மந்த வாயுவான நியானை விட இரண்டு எலக்ட்ரான்கள் கூடுதலாகப் பெற்றிருக்கிறது. எனவே, மக்னீசியம் அதன் வெளிக்கூட்டிலிருந்து இரண்டு எலக்ட்ரான்களை இழந்து நிலையான எலக்ட்ரான் அமைப்பைக் கொண்ட மக்னீசியம் அயனியாக (Mg2+) மாறுகிறது.
ஏற்கனவே விளக்கியதுபோல மக்னீசியம் இழந்த இரண்டு எலக்ட்ரான்களையும் இரு குளோரின் அணுக்கள் ஏற்றுக்கொண்டு மக்னீசியம் குளோரைடு (MgCl2) மூலக்கூறை உருவாக்குகின்றன (படம் 13.8).
அயனிச்சேர்மங்களின் பண்புகள்
ஒரு மூலக்கூறில் உள்ள அணுக்களுக்கிடையேயான பிணைப்பின் தன்மையே அம்மூலக்கூறின் பண்புகளை நிர்ணயிக்கும் முக்கியக் காரணி ஆகும். அந்த வகையில், அயனிச்சேர்மங்களில் அணுக்கள் வலிமையான நிலைமின் கவர்ச்சி விசையால் பிணைக்கப்படுகின்றன. எனவே இப்பிணைப்பிற்குரிய கீழ்க்கண்ட பண்புகளை அயனிச்சேர்மங்கள் பெற்றிருக்கின்றன.
இயல்புநிலை:
நேர்மின் அயனி மற்றும் எதிர்மின் அயனிகள் வலிமைமிகு நிலைமின் கவர்ச்சி விசையால் பிணைக்கப்படுவதன் மூலம் உருவாகும் இச்சேர்மங்களில் அயனிகள் ஒரு முறையான வடிவ ஒழுங்கமைப்பில் அமைந்துள்ளன. எனவே அயனிச்சேர்மங்கள் அறை வெப்பநிலையில் படிகத் திண்மங்களாக உள்ளன.
மின் கடத்துத்திறன்:
அயனிச்சேர்மங்கள் படிகத் திண்மங்கள் ஆகையால் அவற்றின் அயனிகள் மிகவும் நெருக்கமாக மற்றும் வலிமையாக பிணைக்கப்பட்டுள்ளன. அயனிகள் எளிதில் நகர இயலாது. எனவே திண்மநிலையில் அயனிச் சேர்மங்கள் மின்சாரத்தைக் கடத்துவதில்லை. எனினும், உருகிய நிலையில் அல்லது நீர்க்கரைசலில் மின்சாரத்தைக் கடத்துகின்றன.
உருகு நிலை:
வலிமைமிகு நிலைமின் கவர்ச்சி விசையால் நேர்மின் மற்றும் எதிர்மின் அயனிகள் நெருக்கமாக பிணைக்கப்பட்டிருப்பதால் அவற்றைப் பிரிக்க மிக அதிக ஆற்றல் தேவைப்படுகிறது. எனவே அயனிச்சேர்மங்கள் உயர் உருகுநிலை மற்றும் கொதிநிலைகளைக் கொண்டுள்ளன.
கரைதிறன்:
அயனிச்சேர்மங்கள் நீர் போன்ற முனைவுள்ள கரைப்பான்களில் கரையக் கூடியவை. பென்சீன் (C6H6) மற்றும் கார்பன் டெட்ரா குளோரைடு (CCl4) போன்ற முனைவற்ற கரைப்பான்களில் கரைவதில்லை.
அடர்த்தி, கடினத்தன்மை மற்றும் நொறுங்கும் தன்மை:
அயனிச்சேர்மங்களில் வலிமையான நிலைமின் கவர்ச்சி விசையால் அயபிகள் பிணைக்கப்பட்டுள்ளதால், அவை அதிக கடினத் தன்மையையும், அடர்த்தியையும் கொண்டுள்ளன. ஆனால் அவை எளிதில் நொறுங்கும் தன்மை கொண்டவை.
வினைகள்:
அயனிச்சேர்மங்கள், கண நேரத்தில் தீவிரமாக நடைபெறும் அயனி வினைகளில் ஈடுபடுவதால் அவற்றின் வினைவேகம் அதிகம்.
சகப்பிணைப்பு
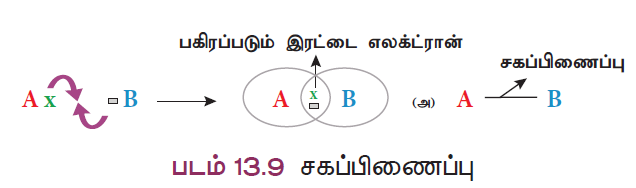
- நிலையான எலக்ட்ரான் அமைப்பைப் பெறும் வகையில் அணுக்கள் அவற்றின் வெளிக்கூட்டில் உள்ள எலக்ட்ரான்களை மற்ற அணுக்களுடன் பங்கீடு செய்து இணைகின்றன. அவ்வாறு இணையும்போது அவற்றிற்கிடையே பிணைப்பை உருவாக்கத் தேவையான இரண்டு எலக்ட்ரான்களை இரு அணுக்களும் சமமாக தலா ஒரு எலக்ட்ரான் வீதம் வழங்குகின்றன.
- இவ்வாறு, இரு அணுக்கள் சமமாக எலக்ட்ரான்களைப் பங்கீடு செய்து அவற்றிற்கிடையே உருவாக்கும் பிணைப்பு சகப்பிணைப்பு எனப்படுகிறது.
- லூயிஸ் விதிப்படி, இரு அணுக்கள் எலக்ட்ரான்களைப் பங்கீடு செய்து சகப்பிணைப்பை உருவாக்கும்போது, அவ்விரு அணுக்களும் நிலையான மந்தவாயு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. சகப்பிணைப்பில் இரு அணுக்களால் பங்கீடு செய்யப்படும் எலக்ட்ரான்கள் அவ்விரு அணுக்களுக்கும் பொதுவானவை ஆகையால் இது அணுப்பிணைப்பு என்றும் அழைக்கப்படுகிறது.
சகப்பிணைப்பின் மூன்று வகைகள்
- ஒற்றை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே ஒரு கோடு (-) பயன்படுத்தப்படுகிறது. (எ.கா) H – H
- இரட்டை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே இரண்டு கோடுகள் (=) பயன்படுத்தப்படுகின்றன. (எ.கா) 0 = 0
- மும்மை சகப்பிணைப்பைக் குறிக்க அணுக்களுக்கிடையே மூன்று கோடுகள் பயன்படுத்தப்படுகிண்றன. (எ.கா) N N
சகப்பிணைப்பு உருவாதல்
A மற்றும் B என இரண்டு அணுக்களைக் கருதுவோம். A அணு தன் வெளிக்கூட்டில் ஒரு எலக்ட்ரானையும், B அணு தன் வெளிக்கூட்டில் ஏழு எலக்ட்ரானையும் பெற்றிருப்பதாகக் கொள்வோம். இவ்விரு அணுக்களும் ஒன்றையொன்று நெருங்கும்போது அவை தலா ஒரு எலக்ட்ரானை மற்றொன்றுடன் பகிர்ந்து கொள்ளும். இதனால் இரண்டு அணுக்களும் தங்கள் இணைதிறன் கூட்டில் முழுவதும் நிரம்பிய எலக்ட்ரான் அமைப்பைப் பெறுவதால் நிலைப்புத்தன்மை அதிகரிக்கிறது.
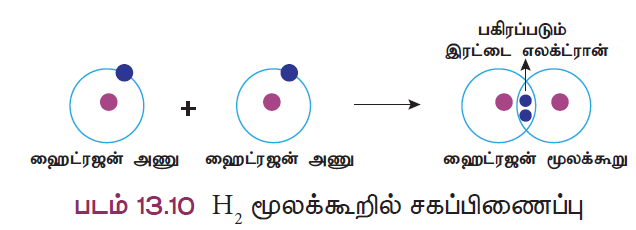
விளக்கம் 1 : ஹைட்ரஜன் மூலக்கூறு உருவாதல் (H2)
இரண்டு ஹைட்ரஜன் அணுக்கள் இணைந்து H2 மூலக்கூறு உருவாகிறது. ஒங்கு இரண்டு ஹைட்ரஜன் அணுக்களும் தங்களின் ஒரு இணைதிறன் எலக்ட்ரானை (1s1) பங்கீடு செய்வதன் மூலம் இரண்டு ஹைட்ரஜன் அணுக்களும் ஹீலியம் அணுவை ஒத்தை நிலையான எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
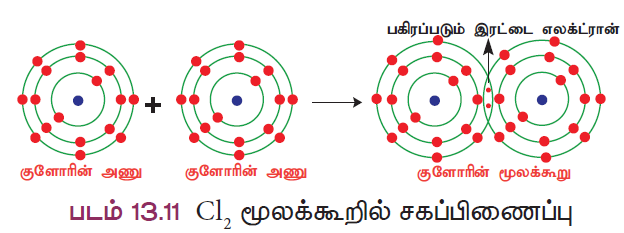
விளக்கம் 2: குளோரின் மூலக்கூறு உருவாதல் (Cl2)
இரண்டு குளோரின் அணுக்கள் இணைந்து குளோரின் மூலக்கூறு உருவாகிறது. ஒவ்வொரு குளோரின் அணுவும், ஏழு இணைதிறன் எலக்ட்ரான்களைப் (2, 5) பெற்றுள்ளன. அவை தலா ஒரு எலக்ட்ரானை தங்களுக்கிடையே பங்கீடு செய்வதன் மூலம் இரண்டு குளோரின் அணுக்களும் நிலைத்த எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன.
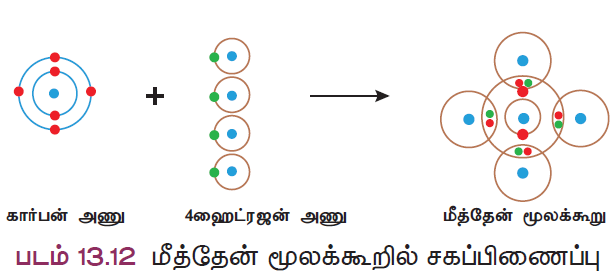
விளக்கம் 3 : மீத்தேன் மூலக்கூறு உருவாதல் (CH4)
ஒரு கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் இணைந்து மீத்தேன் மூலக்கூறு உருவாகிறது. கார்பன் அணுவில் நான்கு இணைதிறன் எலக்ட்ரான்கள் (2, 4) உள்ளன. கார்பன் இந்த நான்கு எலக்ட்ரான்களையும் நான்கு ஹைட்ரஜன் அணுக்களுடன் தலா ஒரு எலக்ட்ரான் வீதம் பகிர்ந்து கொள்கிறது. கார்பன் அணுவின் வெளிக்கூட்டில் முழுவதும் நிரம்பிய எட்டு எலக்ட்ரான் அமைப்பு உருவாவதால் நிலைப்புத்தன்மை அடைகிறது.
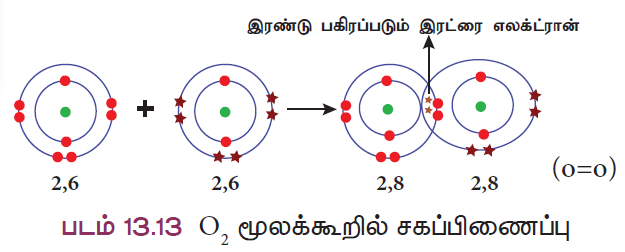
விளக்கம் 4: ஆக்ஸிஜன் மூலக்கூறு உருவாதல் (O2)
இரண்டு ஆக்ஸிஜன் அணுக்கள் இணைந்து ஆக்ஸிஜன் மூலக்கூறு உருவாகிறது. ஒவ்வொரு ஆக்ஸிஜன் அணுவும் தங்களின் வெளிக்கூட்டில் ஆறு இணைதிறன் எலக்ட்ரான்களைப் (2, 6) பெற்றுள்ளன. இரண்டு எலக்ட்ரான்களை தங்களுக்குள்ளே பங்கீடு செய்வதால் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. எனவே ஆக்ஸிஜன் அணுக்களுக்கிடையே இரட்டைப் பிணைப்பு உருவாகிறது.
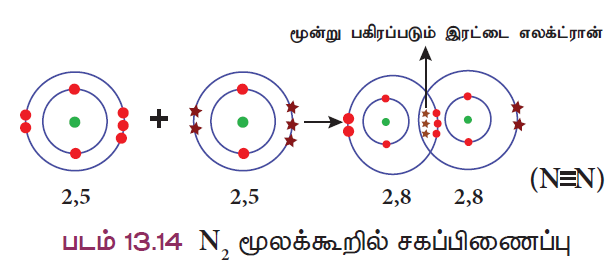
விளக்கம் 5: நைட்ரஜன் மூலக்கூறு உருவாதல் (N2)
நைட்ரஜன் மூலக்கூறு இரண்டு நைட்ரஜன் அணுக்கள் இணைவதால் உருவாகிறது. ஒவ்வொரு நைட்ரஜன் அணுவும் தங்களின் வெளிக்கூட்டில் ஐந்து இணைதிறன் எலக்ட்ரான்களைப் (2 , 5) பெற்றுள்ளன. அவ்விரு நைட்ரஜன் அணுக்களும் தலா மூன்று எலக்ட்ரான்களை தங்களுக்குள்ளே பங்கீடு செய்வதால் இரு அணுக்களும் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. எனவே, நைட்ரஜன் அணுக்களுக்கிடையே மூன்று பிணைப்பு உருவாகிறது.
சகப்பிணைப்புச் சேர்மங்களின் பண்புகள்
சேர்மங்களின் பண்புகள் அவற்றில் உள்ள அணுக்களுக்கிடையேயான பிணைப்பின் தன்மையைப் பொறுத்தே அமையும் என நாம் அறிவோம். சகப்பிணைப்பு மூலம் உருவான சகப்பிணைப்புச் சேர்மங்கள் அயனிச்சேர்மங்களின் பண்புகளிலிருந்து முற்றிலும் மாறுபடுகின்றன.
இயற்பியல் நிலைமை:
சகப்பிணைப்புச் சேர்மங்களின் மூலக்கூறுகளுக்கு இடையே நிலவும் கவர்ச்சி விசையைப் பொறுத்து அவற்றின் பிணைப்பு வலிமையாகவோ அல்லது வலிமையற்றதாகவோ இருக்கலாம். எனவே சகப்பிணைப்பு சேர்மங்கள் வாயு நிலையிலோ, நீர்ம நிலையிலோ அல்லது மென்மையான திண்மங்களாகவோ இருக்கின்றன. எ.கா: ஆக்சிஜன் – வாயு, நீர் – நீர்மம், வைரம் – திண்மம்.
மின்கடத்துத் திறன்:
சகப்பிணைப்புச் சேர்மங்களில் அயனிகள் இல்லை. எனவே இவை மின்சாரத்தைக் கடத்துவதில்லை.
உருகுநிலை:
வைரம், சிலிகன் கார்பைடு போன்ற ஒரு சில சகப்பிணைப்புச் சேர்மங்களைத் தவிர மற்றவை அயனிச்சேர்மங்களை விட குறைந்த உருகுநிலையைப் பெற்றுள்ளன.
கரைதிறன் :
சகப்பிணைப்புச் சேர்மங்கள் பென்சீன் (C6H6), கார்பன் டெட்ரா குளோரைடு (CCl4) போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரையும். நீர் போன்ற முனைவுள்ள கரைப்பான்களில் எளிதில் கரைவதில்லை.
கடினத்தன்மையும் நொறுங்கும் தன்மையும்:
சகப்பிணைப்புச் சேர்மங்கள் கடினத்தன்மை அற்றவையாகவும், நொறுங்கும் தன்மை அற்றவையாகவும் உள்ளன. இவை மென்மையான திண்மங்களாகக் காணப்படுகின்றன.
வினைபடுதிறன்:
சகப்பிணைப்புச் சேர்மங்கள் மூலக்கூறு வினைகளில் ஈடுபடுவதால் இவற்றின் வினைவேகம் குறைவு.
- வேறுபட்ட எலக்ட்ரான் கவர்தன்மை கொண்ட ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் போன்ற அணுக்கள் இணைவதால் முனைவுள்ள கரைப்பான்கள் உருவாகின்றன. எ.கா: நீர், எத்தனால், அசிட்டிக் அமிலம், அம்மோனியா. அயனிச்சேர்மங்கள் இத்தகைய கரைப்பான்களில் எளிதில் கரைகின்றன.
- எலக்ட்ரான் கவர் தன்மையில் குறைந்த அளவே வேறுபாடு கொண்ட கார்பன் மற்றும் ஹைட்ரஜன் போன்ற அணுக்கள் இணைவதால் முனைவற்ற கரைப்பான்கள் உண்டாகின்றன. எ.கா: அசிட்டோன், பென்சீன், டொலுவீன், டர்பண்டைன். சகப்பிணைப்புச் சேர்மங்கள் இத்தகைய கரைப்பான்களில் கரைகின்றன.
ஃபஜானின் விதி
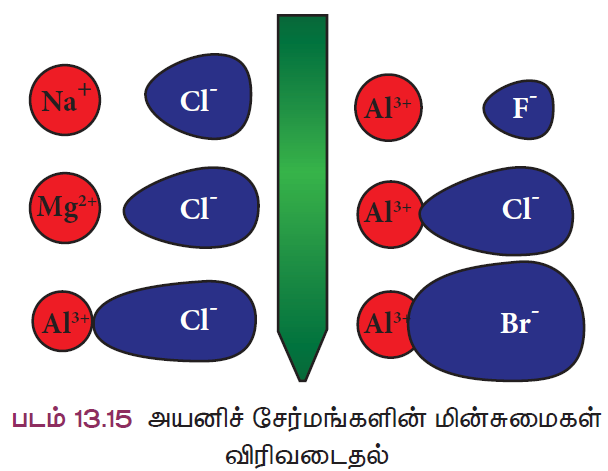
- உலோகம் அயனிப்பிணைப்பு மூலம் அலோகங்களோடு இணைகிறது. அவ்வாறு இணையும் போது அவை அயனிச் சேர்மங்களைத் தருவதை நாம் அறிவோம். ஒரு சேர்மத்திலுள்ள அணுக்கள் நேர் மற்றும் எதிர் மின்சுமை கொண்ட அயனிகளாக முற்றிலுமாக பிரிவுறுதல் முனைவுறுதல் எனப்படும். அவ்வாறு முனைவுற்ற சேர்மங்கள் அயனிச்சேர்மங்கள் எனப்படுகின்றன.
- 1923 ஆம் ஆண்டு ஃபஜான் என்ற அறிவியல் அறிஞர் X-கதிர் படிகநிறமானி ஆய்வுகளின் அடிப்படையில் ஒரு சில அயனிச் சேர்மங்கள், சகப்பிணைப்புச் சேர்மங்களின் பண்புகளைப் பெற்றிருப்பதைக் கண்டறிந்தார்.
- இந்த ஆய்வுகளின் அடிப்படையில் அவர் ஒரு சேர்மம் அயனிப்பிணைப்பைப் பெற்றுள்ளதா அல்லது சகப் பிணைப்பைப் பெற்றுள்ளதா என்பதை ஒரு சில காரணிகளைக் கொண்டு கண்டறிய இரு விதிமுறையை உருவாக்கினார். இவ்வழிமுறைகள் ஃபஜான் விதி எனப்படுகின்றன.
- ஃபஜானின் விதி நேர்மின் அயனியின் மின் சுமையையும், நேர் மற்றும் எதிர் மின் அயனிகளின் உருவ அளவையும் தொடர்புபடுத்துகிறது.
- நேர்மின் அயனியின் உருவ அளவு சிறியதாகவும், எதிர்மின் அயனியின் உருவ அளவு பெரியதாகவும் இருந்தால், பிணைப்பு சகப்பிணைப்புத் தன்மை பெறும்.
- நேர்மின் அயனியின் மின்சுமை அதிகரிக்க அதிகரிக்க சகப்பிணைப்புத் தன்மை அதிகரிக்கும்.
ஃபஜான் விதியின் சுருக்கம்
| அயனித்தன்மை | சகப்பிணைப்புத் தன்மை |
| குறைந்த நேர்மின் சுமை | அதிக நேர்மின் சுமை |
| நேர்மின் அயனி – உருவ அளவு பெரியது | நேர்மின் அயனி – உருவ அளவு சிறியது |
| எதிர் மின் அயனி – உருவ அளவு சிறியது | எதிர் மின் அயனி – உருவ அளவு பெரியது |
- உதாரணத்திற்கு, சோடியம் குளோரைடைக் கருதுவோம். சோடியத்தின் மின்சுமை (+1) குறைவாகவும் அதன் உருவ அளவு பெரியதாகவும் மற்றும் குளோரின் எதிர்மின் அயனியின் உருவ அளவு சிறியதாகவும் உள்ளதால், மின்சுமைகள் எளிதில் பிரிவடைகின்றன.
- ஆனால் அலுமினியம் டிரை அயோடைடில், அலுமினியத்தின் மின்சுமை அதிகம் (+3) மற்றும் அதன் உருவ அளவு சிறியது. அயோடைடு அயனி அலுமினியம் அயனியை விட உருவ அளவில் பெரியது.
- எனவே அவற்றிற்கிடையான மின்சுமை பிரிகையடைந்து முனைவுறுதல் நடைபெறுவதில்லை. ஆகவே அலுமினியம் டிரை அயோடைடு ஒரு சகப்பிணைப்புச் சேர்மம் ஆகும். பின்வரும் படம் அயனிச் சேர்மங்களின் முனைவுறும் தன்மையை எளிமையாக விளக்குகிறது.
ஈதல் சகப்பிணைப்பு உருவாதல்
- எளிய சகப்பிணைப்பு உருவாதலின் போது, பிணைப்பில் ஈடுபடும் இரு அணுக்களும் தலா ஒரு எலக்ட்ரான் வீதம் பங்கீடு செய்து பிணைப்பை உருவாக்குகின்றன.
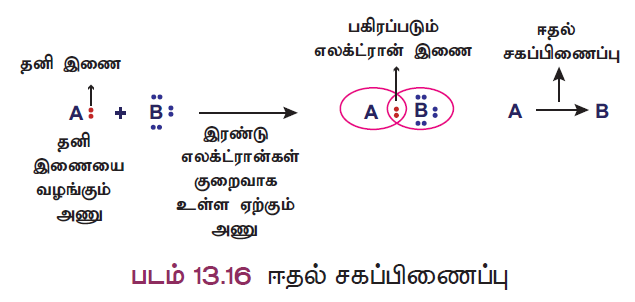
- எனினும், ஒரு சில சேர்மங்களில் சகப்பிணைப்பு உருவாகத் தேவையான இரு எலக்ட்ரான்களையும், பிணைப்பில் ஈடுபடும் ஏதேனும் ஒரு அணு வழங்கி, பிணைப்பை உருவாக்குகிறது. இத்தகைய பிணைப்பு ஈதல் சகப்பிணைப்பு (அ) ஈதல் பிணைப்பு எனப்படுகிறது.
- ஈதல் பிணைப்பில் ஈடுபடும் எலக்ட்ரான்கள் தனி இரட்டை (lone pair) எனப்படுகின்றன. தனி இரட்டை எலக்ட்ரான்களை வழங்கும் அணு ‘ஈனி அணு’ எனவும், அவற்றை ஏற்கும் அணு ‘ஏற்பி அணு’ எனவும் அழைக்கப்படுகிறது. ஈதல் சகப்பிணைப்பு, ஈனி அணுவிலிருந்து ஏற்பி அணுவிற்கு வரையப்படும் அம்புக்குறி ( மூலம் குறிக்கப்படுகிறது.
ஈதல் சகப்பிணைப்பு உருவாதல்
A மற்றும் B என்ற இரு அணுக்களைக் கருதுவோம். A அணுவில் பங்கிடப்படாத தனி இரட்டை எலக்ட்ரான்கள் இருப்பதாகவும், B அணுவில் நிலையான எட்டு எலக்ட்ரான் அமைப்பிற்கு இரண்டு எலக்ட்ரான்கள் குறைவாக இருப்பதாகவும் கொள்வோம். இப்போது A அணு தன் வசம் உள்ள தனி இரட்டை எலக்ட்ரான்களை அணு Bக்கு வழங்கு பிணைப்பை உருவாக்குகிறது. பிணைப்பில் உள்ள இரு எலக்ட்ரான்களையும் A அணு வழங்கியிருந்த போதும் அவற்றை A மற்றும் B ஆகிய இரண்டு அணுக்களும் சமமாகப் பங்கிட்டுக்கொள்கின்றன. இவ்வாறு உருவாகும் பிணைப்பு ஈதல் சகப்பிணைப்பு (A B) எனப்படுகிறது. எ.கா. NH3 BF3
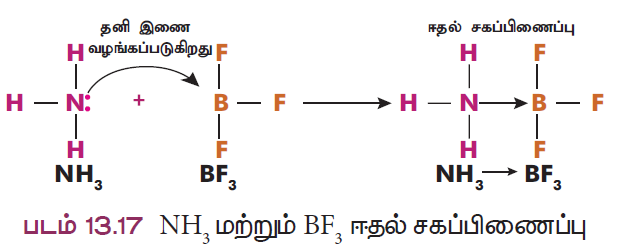
விளக்கம் 1: NH3 BF3 மூலக்கூறு இடையே சகப்பிணைப்பு உருவாதல்
ஒரு சில சேர்மங்களில் ஈதல் சகப்பிணைப்பானது ஒரு மூலக்கூறு, தனித்த இணை எலக்ட்ரான்களை மற்றொரு மூலக்கூறிற்கு வழங்குவதால் உருவாகிறது. எடுத்துக்காட்டாக அம்மோனியா மூலக்கூறு (NH3) தனித்த இணை எலக்ட்ரான்களை போரான் டிரை புளூரைடு (BF3) மூலக்கூறிற்கு வழங்கி ஈதல் சகப்பிணைப்பை உருவாக்குகிறது (NH3 BF3). இங்கு NH3 ஈனி மூலக்கூறாகவும் BF3 ஏற்பி மூலக்கூறாகவும் உள்ளன.
ஈதல் சகப்பிணைப்புச் சேர்மங்களின் பண்புகள்
இயற்பியல் நிலைமை:
இச்சேர்மங்கள் வாயுநிலை, நீர்ம நிலை மற்றும் திண்ம நிலைகளில் காணப்படுகின்றன.
மின்கடத்துத் திறன்:
சகப்பிணைப்புச் சேர்மங்களைப் போலவே, ஈதல் சகப்பிணைப்புச் சேர்மங்களிலும் அயனிகள் இல்லை. எனவே, இவை அரிதில் மின்கடத்திகள் ஆகும்.
உருகுநிலை:
ஈதல் சகப்பிணைப்புச் சேர்மங்களின் உருகுநிலை மற்றும் கொதிநிலை சகப்பிணைப்புச் சேர்மங்களை விட அதிகமாகவும் அயனிச் சேர்மங்களை விட குறைவாகவும் காணப்படுகின்றன.
கரைதிறன்:
நீர் போன்ற முனைவுள்ள கரைப்பான்களில் மிகச்சிறிதளவே கரையும் அல்லது கரைவதில்லை. பென்சீன், டொலுவீன், கார்பன் டெட்ரா குளோரைடு போன்ற முனைவற்ற கரைப்பான்களில் எளிதில் கரைகிறது.
வினைபடுதிறன்:
இச்சேர்மங்கள் மெதுவான மூலக்கூறு வினைகளில் ஈடுபடுகின்றன.
ஆக்சிஜனேற்றம், ஒடுக்கம் மற்றும் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகள்
ஒரு ஆப்பிள் பழத்தை வெட்டி சிறிது நேரம் வைத்திருந்தால் அதன் வெட்டுப்பரப்பு பழுப்பு நிறமாக மாறுவதைக் காணலாம். அதைப்போலவே இரும்புப் பொருள்களில் துருப்பிடித்தலை அன்றாட வாழ்வில் காண்கிறோம். இத்தகைய நிகழ்வுகள் ஏன் நிகழ்கின்றன எனத் தெரியுமா? இவை நிகழக்காரணம் ஆக்ஸிஜனேற்றம் எனும் வினை ஆகும்.

ஆக்ஸிஜனேற்றம்:
ஒரு வேதிவினையில் ஆக்ஸிஜன் சேர்க்கப்படுதலோ, ஹைட்ரஜன் நீக்கப்படுதலோ அல்லது எலக்ட்ரான்கள் நீக்கப்படுதலோ நிகழும் போது அந்த வினை ஆக்ஸிஜனேற்றம் எனப்படுகிறது.
2 Mg + O2 2 MgO (ஆக்ஸிஜன் சேர்க்கப்படுதல்)
CaH2 Ca + H2 (ஹைட்ரஜன் நீக்கப்படுதல்)
Fe2+ Fe3+ + e– (எலக்ட்ரான் நீக்கப்படுதல்)
ஒடுக்கம்:
ஒரு வேதிவினையில் ஹைட்ரஜன் சேர்க்கப்படுதலோ, ஆக்ஸிஜன் நீக்கப்படுதலோ அல்லது எலக்ட்ரான் ஏற்கப்படுதலோ நிகழும் போது அந்த வினை ஒடுக்கம் எனப்படுகிறது.
2 Na + H2 2NaH (ஹைட்ரஜன் சேர்க்கப்படுதல்)
CuO + H2 Cu + H2O (ஆக்ஸிஜன் நீக்கப்படுதல்)
Fe3+ + e– Fe2+ (எலக்ட்ரான் சேர்க்கப்படுதல்)
ஆக்ஸிஜனேற்ற ஒடுக்க வினைகள்:
பொதுவாக, ஒரு வினையில் ஆக்ஸிஜனேற்றமும் ஒடுக்கமும் ஒரே நேரத்தில் நிகழ்கின்றன. ஒரு வினைபடு பொருள் ஆக்ஸிஜனேற்றம் அடையும் போது மற்றொன்று ஒடுக்கமடைகிறது. எனவே, இவ்வகையான வினைகள் ஆக்ஸிஜனேற்ற – ஒடுக்க வினைகள் எனப்படுகின்றன.
2 PbO + C 2Pb + CO2
Zn + CuSO4 Cu + ZnSO4
| ஆக்ஸிஜனேற்றம் | ஆக்ஸிஜனை சேர்த்தல் |
| ஹைட்ரனை நீக்குதல் | |
| எலக்ட்ரானை இழத்தல் | |
| ஒடுக்கம் | ஹைட்ரனை சேர்த்தல் |
| ஆக்ஸிஜனை நீக்குதல் | |
| எலக்ட்ரானை ஏற்றல் |
ஆக்ஸிஜனேற்றி மற்றும் ஒடுக்கிகள்
மற்ற பொருள்களை ஆக்ஸிஜனேற்றம் அடையச் செய்யும் பொருள்கள் ஆக்ஸிஜனேற்றிகள் எனப்படும். இவை மற்றவற்றிடமிருந்து எலக்ட்ரானை வாங்கிக்கொள்வதால் இவற்றை எலக்ட்ரான் ஏற்பிகள் எனவும் அழைக்கிறோம்.
எ.கா: H2O2, MnO4– , CrO3 , Cr2O72-
மற்ற பொருள்களை ஒடுக்கம் அடையச் செய்யும் பொருள்கள் ஒடுக்கிகள் எனப்படும். இவை மற்றவற்றிற்கு எலக்ட்ரானை வழங்குவதால் இவற்றை எலக்ட்ரான் ஈனிகள் எனவும் அழைக்கிறோம்.
எ.கா: NaBH4, LiAlH4 மற்றும் பல்லேடியம், பிளாட்டினம் போன்ற உலோகங்கள்
அன்றாட வாழ்வில் ஆக்ஸிஜனேற்ற வினைகள்
இயற்கையில் காற்றில் காணப்படும் ஆக்ஸிஜனானது, உலோகங்கள் முதல் உயிருள்ள திசுக்கள் வரை பலவற்றை ஆக்ஸிஜனேற்றம் அடையச் செய்கிறது.
- பளபளக்கும் உலோகங்கள், காற்றிலுள்ள ஆக்ஸிஜனுடன் வினைபுரிந்து உலோக ஆக்ஸைடுகளாக மாறுவதால் தங்களின் பளபளப்பை இழக்கின்றன. இதற்கு உலோகங்களின் அரிமானம் (Corrosion) என்று பெயர்.
- புதிதாக வெட்டப்பட்ட காய்கறிகளும், பழங்களும் சிறிது நேரத்தில் நிறம் மாறுவது, அவற்றிலுள்ள நொதிகள் ஆக்ஸிஜனேற்றம் அடைவதால் உண்டாவதாகும்.
- திறந்து வைக்கப்பட்ட உணவுப்பொருள்கள் கெட்டுப்போவதற்கு (Rancidity) அப்பொருள்கள் ஆக்ஸிஜனேற்றம் அடைதலோ காரணமாகும்.
ஆக்ஸிஜனேற்ற எண்
- ஒரு வேதிவினையின் போது ஒரு தனிமத்திலுள்ள அணுவானது இழக்கின்ற அல்லது ஏற்கின்ற எலக்ட்ரான்களின் எண்ணிக்கையே அவ்வணுவின் ஆக்சிஜனேற்ற எண் எனப்படும்.. ஆக்ஸிஜனேற்ற எண் என்பதை ஆக்ஸிஜனேற்ற நிலை எனவும் அழைக்கிறோம்.
- ஒரு அணுவானது எலக்ட்ரானை இழப்பதால் நேர் ஆக்சிஜனேற்ற எண்ணையும், எலக்ட்ரானை ஏற்பதால் எதிர் ஆக்சிஜனேற்ற எண்ணையும் பெறுகிறது. அது எலக்ட்ரானை ஏற்கவோ அல்லது இழக்கவோ இல்லையெனில் அதன் ஆக்சிஜனேற்ற எண் பூஜ்யம்.
- ஒரு மூலக்கூறில் உள்ள அனைத்து அணுக்களின் ஆக்ஸிஜனேற்ற எண்களின் கூடுதல் பூஜ்யமாகும். அயனிகளைப் பொறுத்த வரியில் இக்கூடுதல் மதிப்பு அயனிகளின் மீதுள்ள நிகர மின்சுமைக்குச் சமம்.
- சேர்மங்களில் அதிக எலக்ட்ரான் கவர் தன்மை உள்ள அணு எதிர் ஆக்ஸிஜனேற்ற எண்ணையும், குறைந்த எலக்ட்ரான் கவர் தன்மை கொண்ட அணு நேர் ஆக்ஸிஜனேற்ற எண்ணையும் பெறும்.
எடுத்துக்காட்டு:
- KBr மூலக்கூறில் உள்ள K அணு +1 ஆக்ஸிஜனேற்ற எண்ணையும், Br அணு -1 ஆக்ஸிஜனேற்ற எண்ணையும் பெறுகிறது.
- NH3 மூலக்கூறில் உள்ள N ன் ஆக்ஸிஜனேற்ற எண் – 3
- H ன் ஆக்ஸிஜனேற்ற எண் +1 (உலோக ஹைட்ரைடுகள் தவிர)
- பெரும்பாலான சேர்மங்களில் ஆக்ஸிஜனின் ஆக்ஸினேற்ற எண் –
- பிணைப்பில் உள்ள இணை எலக்ட்ரான்களை தன்னை நோக்கி கவர்ந்திழுக்கும் தன்மை எலக்ட்ரான் கவர் தன்மை எனப்படும்.
ஆக்ஸிஜனேற்ற எண்ணை நிர்ணயித்தல் – கணக்கீடுகள்:
ஒரு நடுநிலையான மின்சுமையற்ற மூலக்கூறின் ஆக்ஸிஜனேற்ற எண் பூஜ்ஜியமாகும்.
விளக்கம் 1:
H2O உள்ள H மற்றும் O ன் ஆக்ஸிஜனேற்ற எண்
H-ன் ஆக்ஸிஜனேற்ற எண் = +1 எனவும் , O-ன் ஆக்ஸிஜனேற்ற எண் = -2 எனவும் கொள்வோம்.
H2O ல் 2 x (+1) +1 x (-2) = 0
2 – 2 = 0
எனவே, Hன் ஆ.எண்: +1, O ன் ஆ.எண்: -2
விளக்கம் 2:
H2SO4 ல் உள்ள S ஆக்ஸிஜனேற்ற எண்
H –ன் ஆக்ஸிஜனேற்ற எண் = +1
O – ஆக்ஸிஜனேற்ற எண் = -2
S – ன் ஆக்ஸிஜனேற்ற எண் x என்க
எனவே, H2SO4-ல்
2 x (+1) + (+1) + x + 4x (-2) = 0
(+2) + x + (-8) = 0
x = +6
ஃ S ன் ஆக்ஸிஜனேற்ற எண் = +6
விளக்கம் 3:
K2Cr2O7-ல் உள்ள Cr ன் ஆக்ஸ்ஜனேற்ற எண்
K – ன் ஆக்ஸிஜனேற்ற எண் = +1
O – ன் ஆக்ஸிஜனேற்ற எண் = -2
Cr – ன் ஆக்ஸிஜனேற்ற எண் x என்க.
எனவே, K2Cr2O7 – ல்
2 x (+1) + 2 x (x) + 7 x (-2) = 0
(+2) + 2x + (-14) = 0
2x = 12
x = 6
ஃCr ன் ஆக்ஸிஜனேற்ற எண் = +6
விளக்கம் 4:
FeSo4 – ல் உள்ள Fe ன் ஆக்ஸிஜனேற்ற எண்
O – ன் ஆக்ஸிஜனேற்ற எண் = -2
S – ன் ஆக்ஸிஜனேற்ற எண் – +6
Fe –ன் ஆக்ஸிஜனேற்ற எண் x என்க.
எனவே, FeSO4 –ல்
x + (+6) +4 x (-2) = 0
x + 6 – 8 = 0
x = +2
ஃ Fe ன் ஆக்ஸிஜனேற்ற எண் = +2