காற்று Notes 8th Science Lesson 11 Notes in Tamil
காற்று
அறிமுகம்
- நமது புவிக்கோளத்தைச் சுற்றியுள்ள வாயுக்களின் கலவையே காற்று ஆகும். புவியில் வாழும் அனைத்து உயிரினங்களும் வாழ்வதற்கு இது மிகவும் அவசியம். காற்றில் 78.09% நைட்ரஜனும், 20.95% ஆக்சிஜனும், 0.93% ஆர்கானும், 0.04% கார்பன் டைஆக்டைடும் சிறிதளவு இதர வாயுக்களும் அடங்கியுள்ளன.
- நாம் ஆக்சிஜனை சுவாசித்து கார்பன் டைஆக்சைடை வெளியிடுகிறோம். தாவரங்கள் கார்பன் டைஆக்சைடை ஒளிச்சேர்க்கைப் பயன்படுத்திக் கொண்டு அக்சிஜனை வெளியிடுகின்றன. மனிதர்கள் தங்களது தேவைகளுக்காக மரங்களை அதிகளவில் வெட்டுவதால் வளிமண்டலத்தில் கார்பன் டைஆக்சைடின் அளவு அதிகரிக்கிறது.
- வளிமண்டலத்தின் வெப்பநிலை அதிகரிப்பிற்கு இதுவும் ஒரு முக்கியக் காரணமாகும். தொழிற்சாலைகள் மற்றும் வாகனங்களில் இருந்து கார்பன் மோனாக்சைடு மற்றும் சல்பர் டைஆக்சைடு போன்ற வாயுக்கள் வெளியிடப்படுகின்றன. இவை புவி வெப்பமயமாதல் மற்றும் அமில மழை போன்ற நிகழ்வுகளுக்குக் காரணமாகி பல பாதிப்புகளை ஏற்படுத்துகின்றன.
- மொத்தத்தில் இன்றைய காலகட்டத்தில் காற்றின் தரம் மிகவும் குறைந்துள்ளது. நாம் இந்தப் பாடப்பகுதியில் பசுமை இல்ல விளைவு, புவி வெப்பமயமாதல், அமில மழை ஆகியவற்றால் ஏற்படும் பாதிப்புகளைப் பற்றி படிக்க இருக்கிறோம்.
- மேலும், புவியில் ஆக்சிஜன், ஹைட்ரஜன் மற்றும் கார்பன் டை ஆக்சைடு ஆகியவற்றின் பரவலையும், அவற்றின் பண்புகளையும் பற்றி படிக்க இருக்கிறோம்.
ஆக்சிஜன்
உலகில் வாழ்கின்ற உயிரினங்கள் அனைத்திற்கும் ஆக்சிஜன் தேவை. ஆக்சிஜன் இல்லாத உலகத்தை நம்மால் நினைத்துக்கூட பார்க்க இயலாது. 1772ஆம் ஆண்டு ஸ்வீடன் நாட்டைச் சேர்ந்த வேதியியலாளர் C.W.ஷீலே ஆக்சிஜனைக் கண்டறிந்தார். இது எரிதலுக்குத் துணை புரிந்ததால் இதனை நெருப்புக்காற்று என்றும், அத்தியாவசியமான உயிர் என்றும் அவர் அழைத்தார். அதே நேரத்தில் பிரிட்டன் அறிவியலாளர் ஜோசப் பிரிஸ்ட்லி என்பவரும் 1774 ஆம் ஆண்டு தனது தனிப்பட்ட முயற்சியால் ஆக்சிஜனைக் கண்டறிந்தார். லவாய்சியர் எனும் அறிவியலாளர் இதற்கு ஆக்சிஜன் என்று பெயரிட்டார். கிரேக்கமொழியில் ஆக்சிஜன் என்றால் ‘அமில உருவாக்கி’ என்று பொருள். முற்கால வேதியலாளர்கள் அமிலம் தயாரிக்க ஆக்சிஜன் அவசியம் எனக் கருதியதால் ஆக்சிஜனுக்கு இப்பெயர் சூட்டப்பட்டது.
ஆக்சிஜனின் சதவீதம்
| தனித்த நிலையில் ஆக்சிஜனின் சதவீதம் | இணைந்த நிலையில் ஆக்சிஜனின் சதவீதம் | ||
| மூலம் | சதவீதம் | மூலம் | சதவீதம் |
| வளிமண்டலம் | 21% | தாவரங்கள் மற்றும் விலங்குகள் | 60 – 70% |
| நீர் | 88 – 90% | சிலிக்கேட்டுகள், கார்பனேட்டுகள் மற்றும் ஆக்சைடுகள் வடிவிலுள்ள தாதுக்கள் | 45 – 50% |
ஆக்சிஜன் பரவல்
பூமியில் அதிகளவு கிடைக்கக்கூடிய வாயுக்களுள் ஆக்சிஜனும் ஒன்று. ஹைட்ரஜன் மற்றும் ஹீலியத்திற்கு அடுத்தபடியாக இந்த அண்டத்தில் பரவலாக மூன்றாவதாகக் காணப்படும் தனிமம் ஆக்சிஜன். ஆக்சிஜனானது தனித்த நிலையிலும், இணைந்த நிலையிலும் கிடைகிறது. வளிமண்டலத்தில் தனித்த நிலையில் ஈரணு வாயு மூலக்கூறாக இது உள்ளது. தாவரங்கள் குளோரோபில் மற்றும் சூரிய ஒளியைப் பயன்படுத்தி குளுக்கோஸ் தயாரிக்கும் ஒளிச்சேர்க்கை எனும் நிகழ்வின் போதும் அதிகப்படியான ஆக்சிஜன் வெளியிடப்படுகிறது.

- ஆக்சிஜனானது நைட்ரஜனைவிட இருமடங்கு நீரில் அதிகமாகக் கரையும் தன்மை உடையது. நைட்ரஜனின் கரைதிறனையே ஆக்சிஜனும் கொண்டிருக்குமானால், கடல், ஆறு, ஏரி போன்ற நீர் நிலைகளில் வாழும் உயிரினங்களுக்கு உயிர் வாழ்தல் மிகவும் கடினமான செயலாக இருக்கும்.
இணைந்த நிலையில் ஆக்சிஜனானது பூமியின் மேலோட்டில் சிலிகேட்டுகளாகவும், உலோக ஆக்சைடுகளாகவும் உள்ளது. மேலும் பூமியில் உள்ள நீரிலும் ஆக்சிஜன் உள்ளது. வளிமண்டலத்தின் மேல் அடுக்குகளில் ஓசோன் எனப்படும் மூவணு மூலக்கூறாக (O3) உள்ளது.
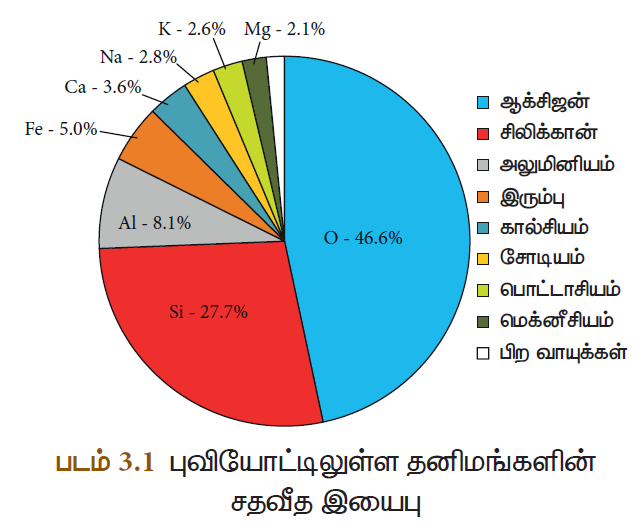
ஆக்சிஜனின் இயற்பியல் பண்புகள்
- ஆக்சிஜன் நிறமற்ற, மணமற்ற, சுவையற்ற வாயு.
- வெப்பத்தையும், மின்சாரத்தையும் கடத்தாது.
- ஆக்சிஜன் குளிர்ந்த நீரில் உடனடியாகக் கரையும்.
- காற்றை விட கனமானது.
- அதிக அழுத்தம் மற்றும் குறைந்த வெப்பநிலைக்கு உட்படுத்தப்படும்போது திரவமாகிறது.
- இது எரிதலுக்குத் துணைபுரிகிறது.
ஆக்சிஜனின் வேதிப்பண்புகள்
- எரிதல்
ஆக்சிஜன் தனித்து எரியும் தன்மை அற்றது. ஆனால் இது பிற பொருள்களின் எரிதலுக்குத் துணை புரியும்.
- ஆக்சிஜனுக்கு தானகவே தீப்பற்றி எரியும் தன்மை இருந்தால் நமது வளிமண்டலத்திலுள்ள அனைத்து ஆக்சிஜனும் எரிய ஒரு தீக்குச்சி மட்டுமே போதுமானதாக இருக்கும்.
- உலோகங்களுடன் வினை
சோடியம், பொட்டாசியம், மெக்னீசியம், அலுமினியம் மற்றும் இரும்பு போன்ற உலோகங்களுடன் ஆக்சிஜன் வினைபுரிந்து அவற்றின் ஆக்சைடுகளைத் தருகிறது. இவை பொதுவாக காரத்தன்மை உடையவை. ஆனால் இவை ஒவ்வொன்றும் ஆக்சிஜனுடன் வேறுபட்ட வினைதிறனுடன் செயல்புரிகின்றன.
உலோகம் + ஆக்சிஜன் உலோக ஆக்சைடு
உதாரணம்

பல்வேறு உலோகங்களுடன் ஆக்சிஜனின் வினைதிறன்
| உலோகம் | வெப்பநிலை | விளைபொருள் |
| K | அறை வெப்பநிலை | பொட்டாசியம் ஆக்சைடு (K2O) |
| Mg | மெதுவாக வெப்பப்படுத்துதல் | மெக்னீசியம் ஆக்சைடு (MgO) |
| Ca | மெதுவாக வெப்பப்படுத்துதல் | கால்சியம் ஆக்சைடு (CaO) |
| Fe
Cu Ag |
அதிக வெப்பம் | இரும்பு ஆக்சைடு (Fe3O4)
காப்பர் ஆக்சைடு (CuO) சில்வர் ஆக்சைடு (Ag2O) |
| Au, Pt | அதிக வெப்பத்திலும் | வினை புரியாது |
ஒரு மெக்னீசிய நாடாவை அது தீப்பற்றும் வரை தீச்சுடரில் வெப்பப்படுத்தவும். பிறகு எரியும் அந்த நாடாவை ஆக்சிஜன் உள்ள குடுவையில் காட்டவும். பிரகாசமான ஒளியுடன் அந்த நாடா எரிவதுடன் வெண்மையான மெக்னீசியம் ஆக்சைடு சாம்பலாகக் கிடைக்கிறது.
- அலோகங்களுடன் வினை
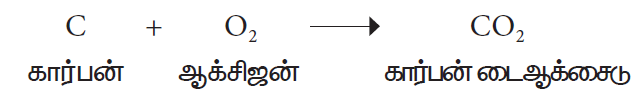
ஹைட்ரஜன், நைட்ரஜன், கார்பன், சல்பர் , பாஸ்பரஸ் போன்ற அலோகங்களுடன் ஆக்சிஜன் வினைபுரிந்து அமிலத்தன்மை வாய்ந்த அலோக ஆக்சைடுகளை உருவாக்குகின்றது.
அலோகம் + ஆக்சிஜன் அலோக ஆக்சைடு
உதாரணம்
அலோகங்களுடன் ஆக்சிஜனின் வினை
| அலோகம் | விளைபொருள் |
| C | கார்பன் டைஆக்சைடு (CO2) |
| N | நைட்ரிக் ஆக்சைடு (NO) |
| S | சல்பர் ஆக்சைடு (SO2) |
| P | பாஸ்பரஸ் டிரைஆக்சைடு (P2O3) or பாஸ்பரஸ் பென்டாக்சைடு (P2O5) |
சிறிதளவு பாஸ்பரஸ் துண்டினை வெப்பப்படுத்தி அதனை ஆக்சிஜனுள்ள குடுவையினுள் நுழைக்கவும். பாஸ்பரஸ் மூச்சடைக்கும் வாசனையுடன் எரிந்து பாஸ்பரஸ் பென்டாக்சைடைத் தருகிறது.
- ஹைட்ரோ கார்பன்களுடன் வினை
ஆக்சிஜன், ஹைட்ரோகார்பன்களுடன் (கார்பனையும், ஹைட்ரஜனையும் கோண்டுள்ள சேர்மங்கள்) வினைபுரிந்து கார்பன் டைஆக்சைடையும், நீரையும் தருகிறது. எடுத்துக்காட்டாக மரம், பெட்ரோல், டீசல், சமையல் எரிவாயு போன்றவை ஹைட்ரோ கார்பன்களின் கலவையாகும். இவை ஆக்சிஜனுடன் எரியும்பொழுது வெப்பம் மற்றும் ஒளி ஆற்றலை உருவாக்குவதால் எரிபொருள்களாகப் பயன்படுகின்றன.
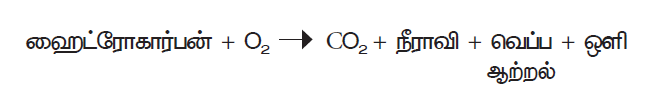
- துருப்பிடித்தல்
காற்று மற்றும் ஈரப்பதத்தின் முன்னிலையில் இரும்பு அதனுடைய நீரேறிய ஆக்சைடாக மாறும் நிகழ்வு துருப்பிடித்தல் எனப்படும். துரு என்பது நீரேறிய இரும்பு ஆக்சைடு ஆகும்.
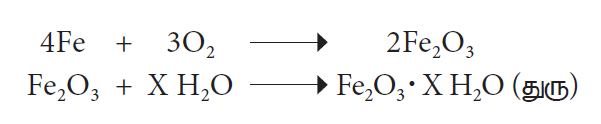
(X என்பது வேறுபட்ட நீர் மூலக்கூறுகளின் எண்ணிக்கையைக் குறிக்கிறது.)
ஆக்சிஜனின் பயன்கள்
- உலோகங்களை வெட்டவும் இணைக்கவும் (வெல்டிங்) பயன்படும் ஆக்சி-அசிட்டிலின் உருளைகளில் இது பயன்படுகிறது.
- எஃகிலுள்ள கார்பன் மாசை நீக்கப் பயன்படுகிறது.
- விலங்குகள் மற்றும் தாவரங்களின் சுவாசத்திற்கு ஆக்சிஜன் உதவுகிறது.
- ராக்கெட்டுகளில் எரிபொருளாகப் பயன்படுகிறது.
- ஆழ்கடலில் மூழ்குபவர்கள், மலை ஏறுபவர்கள், விண்வெளி வீரர்கள் மற்றும் நோயாளிகளுக்குத் தேவைப்படும் செயற்கை சுவாசத்தில் ஆக்சிஜன் பயன்படுகிறது.
- கரித்தூளுடன் ஆக்சிஜனை இணைத்து வெடிபொருள் தயாரிக்கப்படுகிறது.
- மெத்தனால் மற்றும் அம்மோனியா தயாரிக்க இது பயன்படுகிறது.
நைட்ரஜன்
- நைட்ரஜன் மிகவும் முக்கியமான தனிமங்களுள் ஒன்றாகும். தாவரங்களும் விலங்குகளும் வளர்வதற்கு நைட்ரஜன் தேவைப்படுகிறது. அனைத்து உயிரினங்களிலும் (மனிதன் உள்பட) நைட்ரஜன் உள்ளது. அனைத்து உயிரினங்களின் அடிப்படைக் கட்டமைப்புப் பொருள்களான புரோட்டீன்கள் மற்றும் நியூக்ளிக் அமிலங்களில் முக்கியத் தனிமமாக நைட்ரஜன் உள்ளது.
- 1772ஆம் ஆண்டு ஸ்வீடன் நாட்டைச் சேர்ந்த கார்ல் வில்கம் ஷீலே என்பவரால் முதன்முதலில் காற்றிலிருந்து நைட்ரஜன் பிரித்தெடுக்கப்பட்டது. ‘நான் நைட்டரை உருவாக்குகிறேன்’ என்று பொருள்படும் நைட்ரஜன் என்ற வார்த்தையானது ‘நைட்ரோன்’ மற்றும் ‘ஜீன்’ ஆகிய கிரேக்க வார்த்தைகளிலிருந்து உருவானதாகும்.
- நைட்டர் என்றால் நைட்ரஜனின் சேர்மமாகிய பொட்டாசியம் நைட்ரேட் ஆகும். ஆன்டன் லவாய்சியர் இதற்கு அசோட் என்ற பெயரைப் பரிந்துரைத்தார். கிரேக்க மொழியில் அசோட் என்றால் வாழ்வு இல்லாதது என்று பொருள்படும்.
நைட்ரஜன் பரவல்

- மனித உடலில் நான்காவதாக அதிக அளவில் காணப்படும் தனிமம் நைட்ரஜன் ஆகும். மனித உடலின் மொத்த நிறையில் 3% அளவுக்கு இது உள்ளது. நமது அண்டத்தில் பரவலாக ஏழாவது இடத்தில் காணப்படும் தனிமமாகவும் நைட்ரஜன் உள்ளது. சனிக்கோளின் துணைக்கோள்களுள் பெரிய துணைக் கோளான டைட்டனின் வாயுமண்டலத்தில் 98% நைட்ரஜன் உள்ளது.
- நைட்ரஜன் தனித்த நிலையிலும் பிற தனிமங்களுடன் இணைந்த நிலையிலும் காணப்படுகிறது. தனித்த நிலையில் நைட்ரஜன் ஈரணு மூலக்கூறாக (N2) உள்ளது.
- எரிமலையிலிருந்து வெளிப்படும் வாயுக்களிலும், நிலக்கரியை எரிக்கும்பொழுது வெளியாகும் வாயுக்களிலும் நைட்ரஜன் உள்ளது. இணைந்த நிலையில் பொட்டாசியம் நைட்ரேய் எனும் நைட்டர் (KNO3) மற்றும் சோடியம் நைட்ரேட் எனும் சில்லி சால்ட் பீட்டர் (NaNO3) ஆகிய தாதுக்களாகவும் நைட்ரஜன் கிடைக்கிறது. மேலும் கரிமப் பொருள்களாகிய புரதம், என்சைம்கள் மற்றும் நியூக்ளிக் அமிலங்களிலும் நைட்ரஜன் காணப்படுகிறது.
நைட்ரஜனின் இயற்பியல் பண்புகள்
- இது நிறமற்ற, மணமற்ற, சுவையற்ற வாயு.
- இது காற்றை விட லேசானது.
- இது நீரில் சிறிதளவே கரையும்.
- மிகக் குறைந்த வெப்பநிலையில் நைட்ரஜன் திரவமாக மாறுகிறது. பார்ப்பதற்கு இது நீரைப் போல இருக்கும்.
- உறையும்பொழுது வெண்மையான திண்மமாக மாறுகிறது.
- ஆக்சிஜனைப் போலவே, நைட்ரஜனும் லிட்மஸுடன் நடுநிலைத் தன்மையுடன் காணப்படுகிறது.
நைட்ரஜனின் வேதிப்பண்புகள்
1. வேதிவினை
சாதாரண சூழ்நிலைகளில் நைட்ரஜன் வினைபுரிவதில்லை. உயர் வெப்பநிலை, அழுத்தம் அல்லது வினையூக்கியின் முன்னிலையில் பிற தனிமங்களுடன் வினைபுரியும் திறன் கொண்டது.
2. எரிதல்
நைட்ரஜன் தானாக எரிவதில்லை; மற்றும் எரிதலுக்குத் துணைபுரிவதும் இல்லை. எனவே, காற்றிலுள்ள நைட்ரஜன் எரிதலைக் கட்டுப்படுத்துகிறது.
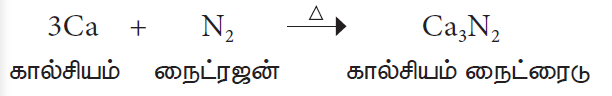
3. உலோகங்களுடன் வினை
லித்தியம், கால்சியம், மெக்னீசியம் போன்ற உலோகங்களுடன் நைட்ரஜன் உயர் வெப்பநிலையில் வினைபுரிந்து அவற்றின் உலோக நைட்ரைடுகளைத் தருகிறது.
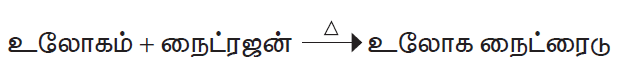
உதாரணம்
4. அலோகங்களுடன் வினை
அலோகங்களான ஹைட்ரஜன், ஆக்சிஜன் போன்றவற்றுடன் நைட்ரஜன் அதிக வெப்ப நிலையில் வினைபுரிந்து அவற்றின் நைட்ரஜன் சேர்மங்களைத் தருகிறது.
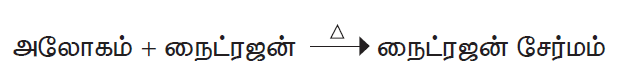
உதாரணம்
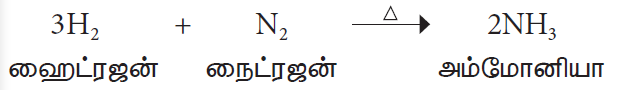
நைட்ரஜனின் பயன்கள்
- திரவ நைட்ரஜன் குளிர்சாதனப் பெட்டிகளில் பயன்படுகிறது.
- சில வேதிவினைகள் நிகழ்வதற்குத் தேவையான மந்தத் தன்மை நிலவச் செய்கிறது.
- அமோனியா தயாரிப்பில் (ஹேபர் முறை) இது பயன்படுகிறது. இம்முறை மூலம் தயாரிக்கப்படும் அமோனியா, உரங்கள் தயாரிப்பிலும், நைட்ரிக் அமிலம் தயாரிப்பிலும் பயன்படுகிறது.
- இது வாகனங்களின் டயர்களில் நிரப்பப்படுகிறது.
- வெப்பநிலைமானிகளில் உள்ள பாதரசம் ஆவியாகாமல் தடுக்க பாதரசத்திற்கு மேலுள்ள வெற்றிடத்தை நிரப்ப நைட்ரஜன் பயன்படுகிறது.
- பலவிதமான வெடிபொருள்களாகிய TNT (ட்ரைநைட்ரோடொலுவின்), நைட்ரோகிளிசரின் மற்றும் துப்பாக்கி வெடிமருந்து ஆகியவை நைட்ரஜனைக் கொண்டு தயாரிக்கப்படுகின்றன.
- உணவுப்பொருள்களைப் பதப்படுத்துதல், துருப்பிடிக்காத இரும்பு தயாரித்தல், தீ விபத்து சார்ந்த பேராபத்துகளைக் குறைத்தல், வெப்பத்தினால் ஒளிரும் விளக்குகள் போன்றவற்றில் நைட்ரஜன் பயன்படுகிறது.

தற்காலங்களில் வாகனங்களின் டயர்களில் அழுத்தப்பட்ட காற்றுக்குப் பதிலாக நைட்ரஜன் நிரப்பப்படுகிறது. இதை நீ கவனித்துள்ளாயா? ஏன் மக்கள் தற்போது நைட்ரஜனைப் பயன்படுத்துகின்றனர்?

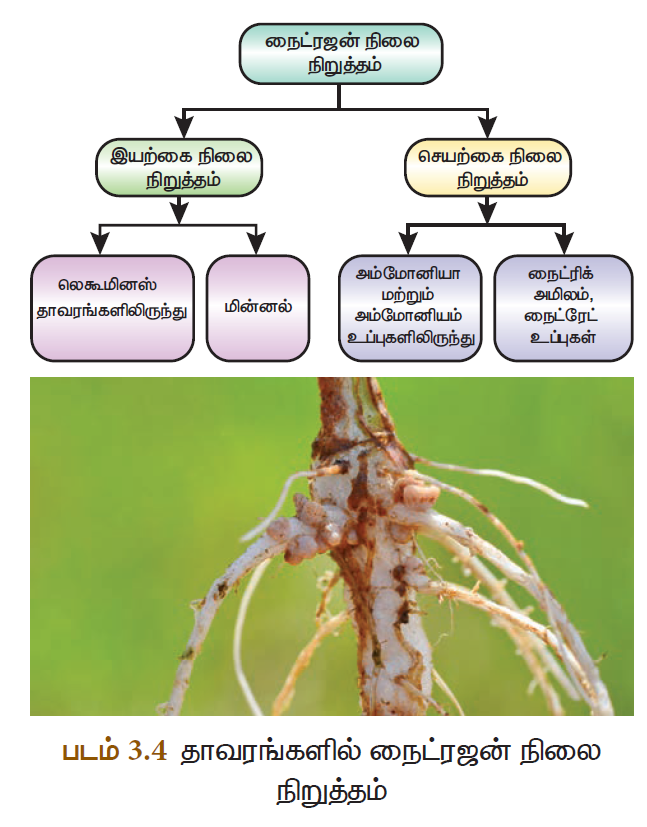
நைட்ரஜன் நிலைநிறுத்தம்
காற்று, மண் மற்றும் உயிரினங்களின் வழியாக நைட்ரஜன் தனிம நிலையிலோ அல்லது சேர்மமாகவோ தொடர்ந்து சுழற்சியில் உள்ளது. எவ்வாறு இயற்கையில் கார்பன் சுழற்சி உள்ளதோ அது போலவே நைட்ரஜன் சுழற்சியும் உள்ளது. இது தாவரங்களின் முறையான வளர்ச்சிக்கு அவசியமாகிறது. காற்றில் உள்ள தனிம நைட்ரஜனை தாவரங்கள் நேரடியாகப் பயன்படுத்த இயலாது. அவற்றிற்கு நீரில் கரையும் நைட்ரஜன் சேர்மங்கள் தேவைப்படுகின்றன. எனவே, தங்களுக்கு நைட்ரேட்டுகளை வழங்கக்கூடிய பல்வேறு செயல்முறைகளை தாவரங்கள் சார்ந்துள்ளன. இவ்வாறு காற்றில் உள்ள நைட்ரஜனை நைட்ரஜன் சேர்மங்களாக மாற்றும் முறை நைட்ரஜன் நிலைநிறுத்தம் எனப்படும். இயற்கையிலேயே நைட்ரஜன் நிலைநிறுத்தப்படுவதோடு மட்டுமின்றி செயற்கையாகவும் நைட்ரஜனை நிலை நிறுத்த இயலும்.
கார்பன் டைஆக்ஸைடு
கார்பன் டைஆக்சைடு ஒரு கார்பன் மற்றும் இரண்டு ஆக்சிஜன் அணுக்களால் பிணைக்கப்பட்ட வேதிச்சேர்மம். அறை வெப்பநிலையில் இது வாயுவாக உள்ளது. இது CO2 என்ற வாய்ப்பாட்டால் குறிக்கப்படுகிறது. பூமியின் வளிமண்டலத்தில் இது காணப்படுகிறது. பூமியால் திருப்பி அனுப்பப்பட்ட சூரிய ஆற்றலை மீண்டும் பூமிக்கே அனுப்பி, உயிரினங்க புவியில் வாழத் தேவையான வெப்பநிலையை இது வழங்குகிறது. ஆனால் வளிமண்டலத்தில் கார்பன் டைஆக்சைடின் அளவு மிகவும் அதிகரிக்கும் பொழுது அது பல தீய வீளைவுகளை ஏற்படுத்துகிறது.
கார்பன் டைஆக்சைடு பரவல்
- பூமியின் வளிமண்டலத்தில் கார்பன் டைஆக்டைடு வாயு 0.03% உள்ளது. தாவரங்கள் மற்றும் விலங்குகள் சுவாசித்தலின்போதும், நொதித்தல் நிகழ்வுகளின்போதும் இது வெளியிடப்படுகிறது.
- இயற்கையில் காணப்படும் பெரும்பாலான கார்பன் டைஆக்ஸைடு எரிமலையிலிருந்து வரும் மேக்மா மூலம் வெளியேற்றப்படுகிறது. எண்னெய் மற்றும் வாயுக்கள் உயிரிய சிதைவுக்குள்ளாகும்பொழுதும் கார்பன் டைஆக்ஸைடு உருவாகிறது.
- மனித செயல்பாடுகளினால் வெளியேறும் கார்பன் டைஆக்ஸைடு, கார்பன் சுழற்சியின் இயற்கைச் சமநிலையைப் பாதிக்கிறது. மனிதனால் உருவாக்கப்படும் கார்பன் டைஆக்சைடு வளிமண்டலத்தில் அதிகமாகி உலகெங்கிலும் வெப்பநிலையை உயர்த்துவதால் பூமியின் வெப்பநிலை உயர்கிறது.
- உலகளாவிய கார்பன் சுழற்சியில் படிம எரிபொருள்களால் வெளியிடப்படும் கார்பன் டைஆக்சைடு ஒரு சிறிய பகுதியாகவே இருந்தாலும் கார்பன் டைஆக்சைடின் அளவு ஒட்டுமொத்தமாக அதிகரித்துக் கொண்டே செல்கிறது. ஏனெனில் இயற்கையான கார்பன் பரிமாற்றத்தினால் அனைத்து கூடுதல் கார்பன் டைஆக்சைடையும் உறிஞ்ச முடிவதில்லை.
கார்பன் டைஆக்ஸைடின் இயற்பியல் பண்புகள்
- கார்பன் டைஆக்சைடு நிறமற்ற, மணமற்ற வாயு.
- காற்றைவிடக் கனமானது (அடர்த்தியானது).
- எரிதலுக்குத் துணைபுரியாது.
- நீரில் ஓரளவுக்கு நன்றாகக் கரையக்கூடியது. மேலும் நீல லிட்மஸ் தாளை சற்று சிவப்பாக மாற்றுகிறது. எனவே இது அமிலத்தன்மை வாய்ந்தது.
- அதிக அழுத்தத்தைப் பயன்படுத்தி இதனைத் திரவமாக்கலாம். அதுமட்டுமல்லாமல் திண்மமாகவும் மாற்றலாம். திட நிலையிலுள்ள கார்பன் டைஆக்சைடு உலர் பனிக்கட்டி என்று அழைக்கப்படுகிறது. இது பதங்கமாதலுக்கு உட்படக்கூடியது.
- வெப்பப்படுத்தும்போது ஒரு பொருள் திடநிலையில் இருந்து திரவநிலைக்கு மாறாமல் நேரடியாக வாயுநிலைக்கு மாறும் நிகழ்வு பதங்கமாதல் எனப்படும்.
கார்பன் டைஆக்சைடின் வேதிப்பண்புகள்
1. எரிதல்
இது தானாக எரியாது; மற்றும் எரிதலுக்கும் துணைபுரியாது.
2. உலோகங்களுடன் வினை
கார்பன் டைஆக்சைடு லேசான உலோகங்களான சோடியம், பொட்டாசியம், கால்சியம் ஆகியவற்றுடன் இணைந்து அவற்றின் கார்பனேட்டுகளை உருவாக்குகின்றது. ஆனால், மெக்னீசியம், அதனுடைய ஆக்சைடையும், கார்பனையும் தருகிறது.
உதாரணம்
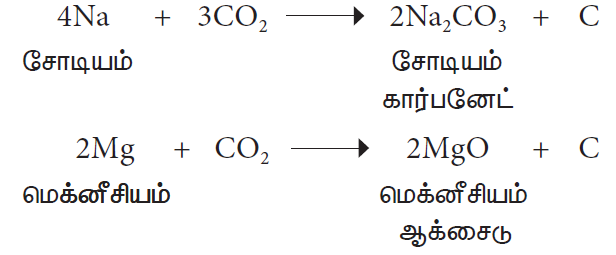
3. சோடியம் ஹைட்ராக்சைடுடன் வினை (காரம்)
சோடியம் ஹைட்ராக்சைடு (காரம்), கார்பன் டைஆக்சைடு (அமிலம்) மூலம் நடுநிலையாக்கல் வினைக்கு உட்படுத்தப்பட்டு சோடியம் கார்பனேட்டையும் (உப்பு) நீரையும் தருகிறது.

4. சுண்ணாம்பு நீருடன்வினை (கால்சியம் ஹைட்ராக்சைடு)
சுண்ணாம்பு நீரில் ஓரளவு கார்பன் டைஆக்சைடை செலுத்தும்பொழுது கரையாத கால்சியம் கார்பனேட் உருவாவதால், கரைசல் பால் போல் மாறுகிறது.
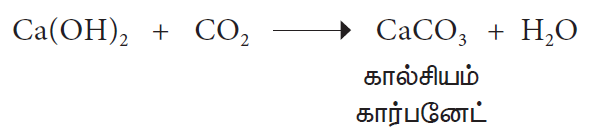
அதிகளவு கார்பன் டைஆக்சைடை சுண்ணாம்பு நீரில் செலுத்தும்பொழுது முதலில் பால் போன்ற நிறம் தோன்றி பின்னர் அது மறைகிறது. இதற்குக் காரணம் கரையக் கூடிய கால்சியம் ஹைட்ரஜன் கார்பனேட், Ca(HCO3)2 உருவாவதேயாகும்.
- வெள்ளிக்கோளின் வளிமண்டலத்தில் 96 – 97% கார்பன் டைஆக்சைடு உள்ளது. கார்பன் டைஆக்சைடின் அளவு அதிகமாக இருப்பதால் வெள்ளியின் மேற்பரப்பால் வெப்பத்தைத் தக்க வைத்துக் கொள்ள முடிகிறது. வெள்ளியின் மேற்பரப்பு வெப்பநிலை தோராயமாக 4620C ஆக இருக்கிறது. எனவேதான் சூரிய குடும்பத்தில் வெள்ளி மிகவும் வெப்பமான கோளாக இருக்கிறது.
கார்பன் டைஆக்சைடின் பயன்கள்
- காற்றோற்றப்பட்ட குளிர்பானங்கள் அல்லது மென்பானங்கள் தயாரிக்க பயன்படுகிறது.
- திட கார்பன் டைஆக்சைடு உலர் பனிக்கட்டி எனப்படுகிறது. இது குளிபதனப் பெட்டிகளில் குளிரூட்டியாகப் பயன்படுகிறது.
- இது மிகவும் குளிர்ச்சியாக இருப்பதால் காற்றிலுள்ள ஈரப்பதம் இதன் மீது விழுந்து அடர்த்தியான வெண்ணிற புகைமூட்டம் போன்ற தோற்றம் உருவாகிறது. இப்பண்பு மேடை நிகழ்ச்சிகளிலும், சினிமாக் காட்சிகளிலும் பயன்படுகிறது.
- கார்பன் டைஆக்சைடு தீயணைப்பான்களில் பயன்படுகிறது.
- சால்வே முறையில் சோடியம் பைகார்பனேட் தயாரிக்க பயன்படுகிறது.
- யூரியா போன்ற உரங்கள் தயாரிக்க அம்மோனியாவுடன் சேர்ந்து பயன்படுகிறது.
- உணவு தானியங்கள், பழங்கள் போன்றவற்றைப் பதப்படுத்த இது பயன்படுகிறது.

- காற்றோற்றப்பட்ட நீர் என்பது அதிக அழுத்தத்தில் கார்பன் டைஆக்சைடு வாயு நீரில் கரைந்துள்ள நிலையாகும். இது சோடா நீர் என்றும் அழைக்கப்படுகிறது.
பசுமை இல்ல விளைவு மற்றும் உலக வெப்பமயமாதல்
- சூரியனிலிருந்து வரும் ஒளிக்கதிர்கள் நிலப்பரப்பு மற்றும் கடற்பரப்பினால் உறிஞ்சப்படுகின்றன. இதன் தொடர்வினையாக இவை வெப்பம் அல்லது அகச்சிவப்புக்கதிர்களை வளிமண்டலத்திற்குள் உமிழ்கின்றன.
- வளிமண்டலத்திலூள்ள சில வாயு மூலக்கூறுகள் இத்தகைய அகச்சிவப்புக் கதிர்களை உறிஞ்சி மீண்டும் அவற்றை அனைத்துத் திசைகளிலும் அனுப்புகின்றன. இவ்வாறு அவை பூமியின் மேற்பரப்பு வெப்பநிலையை தொடர்ந்து ஒரே நிலையில் தக்கவைக்கின்றன.
- அகச்சிவப்புக் கதிர்களை உறிஞ்சும் இவ்வாயுக்கள் பசுமை இல்ல விளைவு எனப்படும். கார்பன் டைஆக்சைடு, நைட்ரஸ் ஆக்சைடு, மீத்தேன், குளோரோபுளுரோ கார்பன் (CFC) போன்றவை புசுமை இல்ல வாயுக்கள் ஆகும்.
- இவ்வாயுக்களின் அளவு தொடர்ந்து வளிமண்டலத்தில் அதிகரிப்பால் பூமியின் மேற்பரப்பு வெப்பநிலை தொடர்ந்து உயர்கிறது. வளிமண்டலத்தில் காற்று மாடுபடுத்திகளின் அளவு தொடர்ந்து அதிகரிப்பதாலும் பசுமை இல்ல விளைவு அதிகமாகி புவியின் வாயுமண்டல வெப்பநிலை சராசரியாக உயர்ந்து கொண்டே வருகிறது. இது உலக வெப்பமயமாதல் எனப்படும்.

உலக வெப்பமயமாதலின் விளைவுகள்
உலக வெப்பமயமாதலால் பின்வரும் விளைவுகள் ஏற்படுகின்றன.
- பனிமலைகள் மற்றும் பனிப்பாறைகள் உருகுகின்றன.
- அடிக்கடி வெள்ளம், மண் அரிப்பு உருவாதல் மற்றும் பருவகாலம் சாராத உயிரிபல்வகைத் தன்மை இழப்புக்குக் காரணமாகிறது.
- நீர் மற்றும் பூச்சிகளால் வரும் நோய்கள் பரவுகின்றன.
உலக வெப்பமயமாதலைத் தடுக்கும் முறைகள்
பூமியையும் அதன் மூலங்களையும் பாதுகாக்கும் பொருட்டு நாம் சில வழிமூறைகளைப் பின்பற்ற வேண்டும். அவை கீழே கொடுக்கப்பட்டுள்ளன.
- படிம எரிபொருள்களை குறைவாகப் பயன்படுத்துதல்.
- காடுகள் அழிவதைத் தடுத்தல்.
- CFC பயன்பாட்டைக் குறைத்தல்.
- அதிக எண்ணிக்கையில் மரங்களை நடுதல்.
- பயன்பாட்டைக் குறைத்தல், மீண்டும் மீண்டும் பயன்படுத்துதல் மற்றும் மறுசுழற்சி செய்தல்.
அமில மழை
நீரின் தூய வடிவம் மழைநீர் ஆகும். எனினும் தொழிற்சாலைகளில் கழிவு வெளியேற்றம், எரிபொருள்களை எரித்தல், எரிமலை வெடிப்பு போன்றவற்றால் காற்றில் கலக்கும் மாசுபடுத்திகளான நைட்ரஜன், சல்பர் ஆக்சைடுகள் போன்றவை மழைநீரில் கரைந்து நைட்ரிக் அமிலம் மற்றும் சல்பூரிக் அமிலங்களை உருவாக்கி மழைநீரை அமிலத்தன்மை உடையதாக்குகின்றன. இதனால் அமில மழை உருவாகிறது.

- தூய மழை நீரின் pH மதிப்பு 5.6 ஆக இருக்கிறது. ஆனால் அமில மழையின் pH மதிப்பு 5.6 ஐ விடக் குறைவு. ஏனெனில் வளிமண்டலத்திலுள்ள கார்பன் டைஆக்சைடு இந்நீரில் கரைந்திருக்கிறது.
அமில மழையின் விளைவுகள்
அமில மழை பல விளைவுகளை ஏற்படுத்துகிறது. அவற்றுள் சில கீழே கொடுக்கப்பட்டுள்ளன.
- மனிதர்களின் கண்களிலும் தோலிலும் எரிச்சலை உண்டாக்குகிறது.
- விதை முளைத்தலையும், வளர்தலையும் தடை செய்கிறது.
- மண்ணின் வளத்தை மாற்றுவதோடு தாவரங்களையும், நீர்வாழ் உயிரினங்களையும் அழிக்கிறது.
- கட்டடங்கள் மற்றும் பாலங்களின் அரிப்பிற்குக் காரணமாகிறது.
அமில மழையைத் தடுக்கும் வழிமுறைகள்
அமில மழையின் பாதிப்புகளை கீழ்க்கண்ட வகைகளில் தடுக்கலாம்.
- பெட்ரோல், டீசல் போன்ற படிம எரிபொருள்களின் பயன்பாட்டைக் குறைத்தல்.
- அழுத்தப்பட்ட இயற்கை வாயுவைப் பயன்படுத்துதல்.
- மாற்று எரிபொருளைப் பயன்படுத்துதல்.
- தொழிற்சாலைக் கழிவுகளை பாதுகாப்பான முறையில் வெளியேற்றுதல்.