அணு அமைப்பு Notes 7th Science Lesson 4 Notes in Tamil
7th Science Lesson 4 Notes in Tamil
4] அணு அமைப்பு
அறிமுகம்:
நம்மைச் சுற்றிக் காணப்படும் அனைத்து பருப்பொருள்களும் மூலக்கூறுகளால் ஆனவை என்பதனையும், மூலக்கூறுகள் என்பவை ஒரே விதமான தனிமத்தின் அணுக்கள் அல்லது பல்வேறு விதமான தனிமத்தின் அணுக்களால் ஆனதாகும் என்பதனையும் கற்று அறிந்து உள்ளோம்.
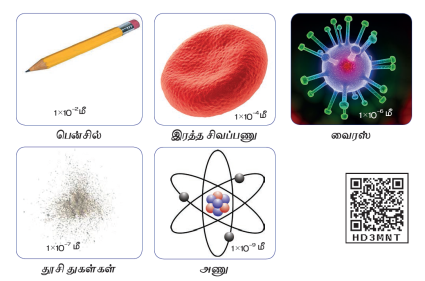
ஒரு அணு எவ்வளவு சிறியது என்பது தெரியுமா?
மனிதனின் தடிமனான முடியைக் காட்டிம் ஆயிரம் மடங்கு சிறியது. அதன் சராசரி விட்டம் 0.0000000001மீ. அல்லது 1 10-9மீ. இதன் அளவினை நமக்கு தெரிந்த கீழ்க்காணும் பொருள்களுடன் ஒப்பிட்டு பார்ப்போம்.
பென்சில் சிவப்பு இரத்த செல்
வைரஸ் தூசுப்பொருள் மற்றும் அணு
1 x 10-2 மீ 1 x 10-4 மீ
1 x 10-6 மீ 1 x 10-7 மீ
1 x 10-9 மீ
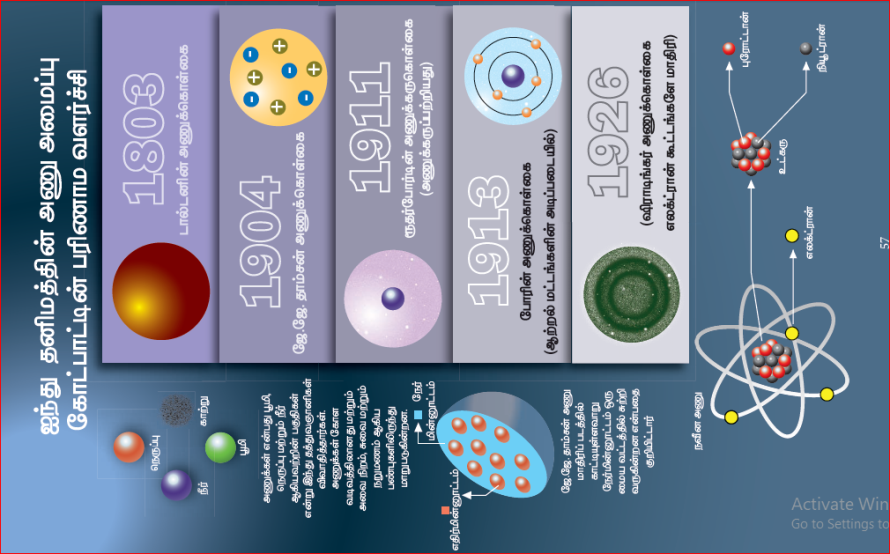
அணுவினை பற்றிய கொள்கையின் பரிணாம வளர்ச்சி:
அணுவின் அமைப்பினை பற்றி அநேக அறிவியலாளர்கள் ஆய்வுகளை மேற்கொண்டு தங்கள் கொள்கைகளை வெளியிட்டனர். அவர்களின் ஆய்வுகள் அணுவின் அமைப்பு பற்றிய கொள்கைகளில் முன்னேற்றத்தினை ஏற்படுத்தின. டால்டன், தாம்ஸன், ரூதர்போர்டு ஆகியோரின் கொள்கைகள் இங்கு கொடுக்கப்பட்டுள்ளன.
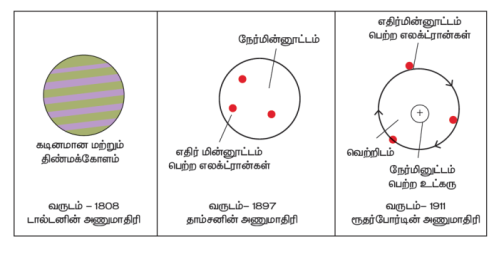
டால்டனின் அணுக்கொள்கை:

ஜான் டால்டன் 1808-ஆம் ஆண்டு அணுக்கொள்கையை வெளியிட்டார். பருப்பொருள்கள் மிகச் சிறிய துகள்களால் உருவாக்கப்பட்டிருக்கின்றன. அத்துகள்களுக்கு டால்டன் அணு எனப்பெயரிட்டார். மேலும் அணு என்பது மிகச்சிறிய பிரிக்க இயலாத துகள் ஆகும். அது கோளவடிவில் உள்ளது. அவரின் கொள்கையானது அணுவில் காணப்படும் நேர் மற்றும் எதிர் மின்னூட்டங்களை பற்றி எவ்வித விளக்கத்தினையும் அளிக்கவில்லை.
இதன் காரணமாக டால்டனின் அணுக்கொள்கையால் பருப்பொருளின் பல பண்புகளை விளக்க இயலவில்லை.
தாம்சனின் அணுக்கொள்கை:

1897ஆம் ஆண்டு J.J.தாம்சன் அணுவினை பற்றிய மற்றொரு கொள்கையை வெளியிட்டார். இவர் அணுவினை தர்பூசணி பழத்துடன் ஒப்பிட்டார். தர்பூசணியில் சிகப்பு பகுதி காணப்படுவது போல அணுவில் நேர் மின்னூட்டம் காணப்படுகிறது. தர்பூசணியில் விதை பதிந்து காணப்படுவது போல் எதிர் மின்னூட்டம் நேர்மின்னூட்டத்தில் பதிந்து காணப்படுகிறது. இந்த எதிர் மின்னூட்டத்தினை தாம்சன் எலக்ட்ரான் என அழைத்தார். இக்கொள்கையின்படி அணுவின் நேர் மற்றும் எதிர் மின்னூட்டங்கள் சம எண்ணிக்கையில் காணப்படுகிறது. இதன் காரணமாக அணுவானது எவ்வித மின்சுமையையும் கொண்டிருக்கவில்லை.
சோதனையின் மூலமாக அணுவில் எதிர்மின்சுமை பெற்ற துகள்களான எலக்ட்ரான்கள் காணப்படுகின்றன என நிருபித்தது தாம்சனின் மிகப்பெரிய கண்டுபிடிப்பாகும். இக்கண்டுபிடிப்பிற்காக அவருக்கு 1906 ஆம் ஆண்டு நோபல் பரிசு வழங்கப்பட்டது. இக்கொள்கையானது அணு ஏன் மின்சுமை அற்று உள்ளது என்பதனை விளக்கிய போதிலும் சில குறைபாடுகள் இக்கொள்கையில் காணப்பட்டன.
ரூதர்போர்டின் அணுக்கொள்கை:

ரூதர்போர்டு
தாம்சனின் கொள்கையில் குறைபாடுகள் இருந்தன. எர்னட் ரூதர்போர்டு ஒரு நல்ல புரிதலை ஏற்படுத்தியது. இவர் ஒரு சோதனையை மேற்கொண்டார். இவர் மெல்லிய தகங்கத் தகட்டினை நேர்மின்னூட்டம் கொண்ட ஆல்பா கதிர்களை கொண்டு மோதச் செய்தார். அதிக திசைவேகம் கொண்ட பெரும்பான்மையான ஆல்பா கதிர்கள் எவ்வித தடைப்பொருள்களின் மீதும் மோதாமல் தங்கத் தகட்டினை ஊடுருவிச் செல்வதைக் கண்டறிந்தார். மிகச் சில ஆல்பா கதிர்கள் தங்கத் தகட்டின் மீது மோதி பின்னோக்கி வருவதையும் கண்டறிந்தார்.
ரூதர்போர்டு இதனை மிக முக்கியமாக கருதினார். துப்பாக்கி குண்டானது மெல்லிய காகிதத்தின் மீது மோதி பின்னோக்கி வந்தால் அது எவ்வளவு வியப்பானதோ அதுபோல் இந்நிகழ்வு வியப்பாக உள்ளது என அவர் விவரித்தார்.
இச்சோதனையின் அடிப்படையில் ரூதர்போர்டு தனது புகழ்ப்பெற்ற அணுக்கொள்கையை வெளியிட்டார். அவரின் கருத்துக்களாவன:
- அதிக அளவிலான ஆல்பா கதிர்கள் தங்கத் தகட்டினை ஊடுருவி செல்கிறது எனில் அணுவானது பெரும்பான்மையான வெற்றிடத்தினை கொண்டிருக்க வேண்டும்.
- எந்த பகுதியிலிருந்து நேர்மின்னூட்டம் பெற்ற கதிர்கள் பின்னோக்கி வந்ததோ அப்பகுதி முழுவதும் நேர்மின்தன்மை பெற்றதாக இருக்க வேண்டும். ஆனால்
அணுவின் பகுதிப்பொருள்கள் கண்டறிந்த காலம்:
அப்பகுதியின் அளவானது வெற்றிடத்தினை ஒப்பிடும்போது அளவில் மிகச்சிறியதாக இருக்க வேண்டும்.
இதனை அடிப்படையாக கொண்டு ரூதர்போர்டு அணு அமைப்பினை பற்றிய அவரது கொள்கையினை வெளியிட்டார். இக்கொள்கைக்காக அவருக்கு வேதியியலுக்கான நோபல் பரிசு வழங்கப்பட்டது.
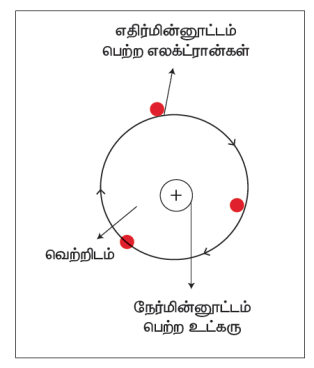
ரூதர்போர்டின் கொள்கைகளாவன:
- அணுவின் மையமான அணுக்கருவானது நேர்மின்தன்மை கொண்டதாக உள்ளது. அணுவின் பெரும்பான்மையான நிறையான அதன் மையத்தில் அமைந்துள்ளது.
- அணுக்கருவினைச் சுற்றி எதிர்மின்தன்மை கொண்ட எலக்ட்ரான்கள் ஒரு குறிப்பிட்ட வட்டப்பாதையில் சுற்றி வருகின்றன.
- அணுவின் அளவோடு ஒப்பீடும்போது அணுக்கருவானது அளவில் மிகமிகச் சிறியதாகும்.
அடிப்படை அணுத் துகள்கள்:
இருபதாம் நூற்றாண்டில் ஏற்பட்ட கண்டுபிடிப்புகள் அனைத்து தனிமங்களின் அணுக்களும் மிகச்சிறிய அணுக்கூறுகளான எலக்ட்ரான், புரோட்டான் மற்றும் நியூட்ரானால் ஆனது என்பதனை நிருபித்தன. ஹைட்ரஜன் அணுவின் எலக்ட்ரானுக்கும் கார்பன் அணுவின் எலெக்ட்ரானுக்கும் இடையில் எவ்வித வெறுபாடும் இல்லை.
இதேபோல் அனைத்து தனிமங்களின் புரோட்டான்களும், நியூட்ரான்களும் ஒத்த பண்புகளை கொண்டுள்ளன. அணுவினை உருவாக்கும் இத்துகள்கள் அணுவின் அடிப்படைத்துகள்கள் என அழைக்கப்படுகின்றன.
புரோட்டான்கள்:
புரோட்டான்கள் என்பவை அணுக்கருவினுள் அமைந்துள்ள நேர்மின்னூட்டம் பெற்ற துகள்கள் ஆகும். இவற்றின் நேர்மின்னூட்டத்தின் மதிப்பு எலக்ட்ரான்கள் எலக்ட்ரான்கள் பெற்றுள்ள எதிர் மின்னூட்டத்தின் மதிப்பிற்குச் சமமாகும்.
நியூட்ரான்கள்:
இவை அணுக்கருவினுள் அமைந்துள்ளன. நியூட்ரான்கள் எவ்வித மின்சுமையும் கொண்டிருக்கவில்லை. ஹைட்ரஜன் தவிர அனைத்து அணுக்கருக்களும் நியூட்ரான்களைக் கொண்டுள்ளன.
எலக்ட்ரான்கள்:
இவை எதிர் மின்னூட்டம் பெற்ற துகள்கள் ஆகும். இவை அணுக்கருவினைச் சுற்றி ஒரு குறிப்பிட்ட வட்டப்பாதைகளில் சுற்றி வருகின்றன.
புரோட்டான் மற்றும் நியூட்ரானின் நிறையுடன் ஒப்பிடும்போது ஒரு எலக்ட்ரானின் நிறை புறக்கணிக்கத்தக்க அளவில் உள்ளது. எனவே ஒரு அணுவின் நிறையானது அணுக்கருவினுள் அமைந்துள்ள புரோட்டான்கள் மற்றும் நியூட்ரான்களின் நிறையினை மட்டுமே சார்ந்திருக்கும்.
அணுக்கருவினுள் காணப்படும் இரண்டு வகையான துகள்களான புரோட்டான்கள் மற்றும் நியூட்ரான்கள் ஆகியவை நியூக்ளியான்கள் என அழைக்கப்படுகின்றன.
அணுக்கருவின் வெளியே காணப்படும் அனைத்து எலக்ட்ரான்களின் மொத்த எதிர் மின்னூட்டமானது அணுக்கருவின் உள்ளே காணப்படும் புரோட்டான்களின் மொத்த நேர் மின்னூட்டத்திற்குச் சமமாகும். இதன் காரணமாக அணுக்கள் மின் நடுநிலைமையுடன் காணப்படுகின்றன.
ஓர் அணுவும் சூரிய மண்டலமும் ஒரே மாதிரியான அமைப்பினை கொண்டு காணப்படுகின்றனவா?
அடிப்படைத் துகள்களின் மின்சுமை மற்றும் நிறை
| துகள் | கண்டறிந்தவர் | குறியீடு | மின்சுமை | நிறை (நிறை (கி.கி.ல்) |
| புரோட்டான் | எர்னாஸ்ட் ரூதர்போர்டு | P | +1 | 1.6726 x 10-27 |
| எலக்ட்ரான் | சர் ஜான் ஜோஸப் தாம்ஸன் | e | -1 | 9.1093 x 10-31 |
| நியூட்ரான் | ஜேம்ஸ் சாட்விக் | N | 0 | 1.6749 x 10-27 |
ஆமாம்! அணுவும் சூரிய மண்டலமும் ஒரே மாதிரியான அமைப்பினை கொண்டுள்ளன. சூரிய மண்டலத்தினை போலவே அணுவானது அணுக்கருவினை மையத்தில் கொண்டுள்ளது. அதனைச் சுற்றி எலக்ட்ரான்கள் வெவ்வேறு வட்டப்பாதைகளில் சுற்றி வருகின்றன.
அணு எண் மற்றும் நிறை எண்:
எல்லாத் தனிமங்களும் ஒரே மாதிரியான எலக்ட்ரான்கள், புரோட்டான்கள் மற்றும் நியூட்ரான்களால் ஆனது எனில், ஓர் கார்பன் அணு, ஓர் இரும்பு அணுவில் இருந்து எவ்வாறு மாறுபடுகிறது? தொடர்ந்து நிகழ்ந்த ஆய்வுகளில் மூலம் ஓர் அணுவின் உட்கருவினுள் உள்ள புரோட்டான்களே அந்தத் தனிமத்தினை நிர்ணயம் செய்கிறது என்று அறிந்தனர். எடுத்துக்காட்டாக, ஒரு அணுவின் உட்கருவினுள் ஒரேயொரு புரோட்டான் இருந்தால் அத்தகைய அணு ஹைட்ரஜன் அணுவாகும். ஒரு அணுவின் உட்கருவினுள் எட்டு புரோட்டான்கள் இருந்தால் அது ஆக்ஸிஜன் அணுவாகும்.
அணு எண்:
ஒரு அணுவில் காணப்படும் எலக்ட்ரான்கள் அல்லது புரோட்டான்களின் மொத்த எண்ணிக்கையே அந்த அணுவின் அணு எண் ஆகும். இது Z என்ற எழுத்தால் குறிக்கப்படுகிறது. நமக்கு ஓர் அணுவின் அணு எண் தெரியுமானால் நம்மால் அவ்வணுவில் காணப்படும் எலக்ட்ரான்கள் அல்லது புரோட்டான்களின் எண்ணிக்கையை கண்டறிய இயலும்.
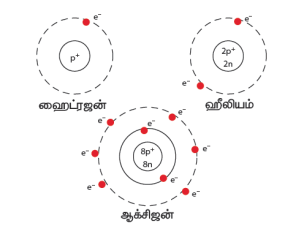
மேலே கொடுக்கப்பட்டிருக்கும் படங்களை கவனிக்கவும். ஹைட்ரஜன் அணுக்கருவானது ஒரே ஒரு புரோட்டானைக் கொண்டுள்ளது. அணுக்கருவிற்கு வெளியே ஒரு எலக்ட்ரான் மட்டுமே சுற்றி வருகிறது. எனவே ஹைட்ரஜனின் அணு எண் Z=1 ஆகும்.
ஹீலியம் அணுவானது அதன் அணுக்கருவினுள் இரண்டு புரோட்டான்களையும் அணுக்கருவிற்கு வெளியே இரண்டு எலக்ட்ரான்களையும் கொண்டுள்ளது. எனவே அதன் அணு எண் Z=2 ஆகும்.
படத்தில் கொடுக்கப்பட்ட ஆக்சிஜனின் அணு அமைப்பினை காணவும். அதன் அணு எண் யாது?
நிறை எண்:
அணுவின் மொத்த நிறையும் அதன் அணுக்கருவினுள் அமைந்துள்ளதைக் கண்டோம். இதிலிருந்து நாம் நிறை எண்ணினை பெற முடியும். நிறை எண் என்பது அணுக்கருவினுள் உள்ள மொத்த புரோட்டான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையின் கூடுதலுக்குச் சமமாகும்.
நிறை எண் = புரோட்டான்களின் எண்ணிக்கை + நியூட்ரான்களின் எண்ணிக்கை
A = p + n
ஒரு லித்தியம் அணுவானது 3 புரோட்டான்களையும் 4 நியூட்ரான்களையும் கொண்டுள்ளது. எனவே அதன் நிறை எண் A = 3 + 4 = 7.
சோடியம் அணுவானது 11 புரோட்டான்களையும் 12 நியூட்ரான்களையும் கொண்டுள்ளது. எனவே அதன் நிறை எண் A = 11 + 12 = 23.
தனிம ஆவர்த்தன அட்டவணையில் உள்ள தனிமங்கள் அனைத்துமே எலக்ட்ரான்கள், புரோட்டான்கள் மற்றும் நியூட்ரான்களின் சேர்க்கையாகும். கீழே சில உதாரணங்கள் கொடுக்கப்பட்டுள்ளன.
| தனிமம் | குறியீடு | சேர்க்கை |
| கார்பன் | 6C12 | 6p, 6e, 6n |
| பெரிலியம் | 4Be12 | 4p,4e,5n |
| நைட்ரஜன் | 7 N14 | 7p, 7e, 7n |
| போரான் | 5B11 | 5p, 5e, 6n |
தனிமங்கள் அவற்றின் குறியீடுகளும் அவற்றின் அணு எண் மற்றும் நிறை எண்ணுடன் கீழே கொடுக்கப்பட்டுள்ளன.
| தனிமம் | குறியீடு | அணு எண் | புரோட்டான்கள் | நியூட்ரான்கள் | நிறை எண் |
| ஹைட்ரஜன் | H | 1 | 1 | 0 | 1 |
| ஹீலியம் | He | 2 | 2 | 2 | 4 |
| அலுமினியம் | Al | 13 | 13 | 14 | 27 |
| ஆக்ஸிஜன் | O | 8 | 8 | 8 | 16 |
| சோடியம் | Na | 11 | 11 | 12 | 23 |
இணைதிறன்:
பல்வேறு மனிதர்கள் பல்வேறு எண்ணிக்கையில் கைகளை கொண்டிருப்பதாக கற்பனை செய்து கொள்வோம். சிலர் ஒரு வகையினையும், சிலர் இரு கைகளையும், வேறு சிலர் மூன்று கைகளையும் கொண்டுள்ளனர். மற்றும் சிலர் நான்கு கைகளை கொண்டுள்ளனர். எந்த ஒரு மனிதரும் நான்கு கைகளுக்கு மேல் கொண்டிருக்கவில்லை எனக் கற்பனை செய்வோம். நான்கு கைகள் கொண்ட ஒருவர், ஒரே நேரத்தில் வேறு நான்கு நபர்களுடன் தனது கைகளைக் இணைத்துக் கொள்ள முடியும். ஆனால் கைகள் இல்லாத ஒருவர் யாருடனும் கைகளை இணைத்துக் கொள்ள முடியாது. இதேபோன்று, சில அணுக்கள் ஓர் எலக்ட்ரானையும் சில இரு எலக்ட்ரான்களையும், சில மூன்று எலக்ட்ரான்களையும், சில நான்கு எலக்ட்ரான்களையும் பிணைத்து வைத்திருக்க கூடிய தன்மையை பெற்று இருக்கும். வேறு சில எந்த ஒரு எலக்ட்ரானையும் பிணைத்து வைத்திருக்கக்கூடிய தன்மையை பெறாமல் இருக்கும். அணுக்களின் இத்தகைய பண்பிற்கு இணைதிறன் என்று பெயர்.
ஐசோடோப்புகள்:
ஒரே தனிமத்தின் அணுக்கள் வெவ்வேறு எண்ணிக்கையுள்ள நியூட்ரான்களைப் பெற்றிருக்கலாம். அத்தகைய அணுக்கள் ஒரே அணு எண்ணையும் வெவ்வேறு நிறை எண்களையும் வெவ்வேறு நிறை எண்களையும் பெற்றுள்ளன. அவை ஐசோடோப்புகள் என அழைக்கப்படுகின்றன. உதாரணமாக ஹைட்ரஜன் அணுவானது மூன்று ஐசோடோப்புகளை பெற்றுள்ளன. அவை ஹைட்ரஜன் (1H1), டியூட்ரியம் (1H2), டிரிட்டியம் (1H3).
ஐசோபார்கள்:
ஒரே நிறை எண்ணையும் வெவ்வேறு அணு எண்களையும் கொண்ட அணுக்கள் ஐசோபார்கள் எனப்படும். (எ.கா) கால்சியம் – 40 மற்றும் ஆர்கான் – 40.
ஓர் அணு பிற அணுவுடன் இணையக்கூடிய திறனிற்கு இணைத்திறன் என்று பெயர். ஓர் அணுவின் இணைத்திறன் அது எத்தனை ஹைட்ரஜன் அணுக்களை பிணைத்து வைத்திருக்க இயலும் என்பதனை கொண்டு அளவிடப்படுகிறது. எடுத்துக்காட்டாக, ஓர் ஆக்ஸிஜன் அணு மற்ற இரு ஹைட்ரஜன் அணுக்களுடன் இணைந்து ஒரு நீர் மூலக்கூற்றினை உருவாக்கும். இதனால் ஆக்ஸிஜனின் இணைதிறன் இரண்டாகும். குளோரினைப் பொறுத்தவரையில், அது ஒரேயொரு ஹைட்ரஜன் அணுவுடன் மட்டுமே இணைந்து ஹைட்ரோகுளோரிக் அமிலத்தை உருவாக்கும். எனவே குளோரினின் இணைதிறன் ஒன்றாகும். மீத்தேன் என்ற சேர்மத்தில் ஒரு கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் இணைந்து என்று உருவாகிறது. உங்களால் மீத்தேனில் உள்ள கார்பன் அணுவின் இணைதிறனை யூகிக்க முடிகிறதா? அம்மோனியா மூலக்கூறில், நைட்ரஜன் அணு மூன்று ஹைட்ரஜன் அணுக்களுடன் இணையும். அம்மோனியாவில் உள்ள நைட்ரஜனின் இணைதிறன் மதிப்பு என்ன?
ஒரு தனிமம் மற்ற தனிமங்களுடன் இணையும் திறன் இணைதிறனாகும். வெவ்வேறு தனிமங்களின் அணுக்கள் அல்லது ஒரே தனிமத்தின் அணுக்கள் இணைந்து மூலக்கூறுகள் உருவாகும். ஓர் தனிமம் தன்னைப் போன்ற மற்ற அணுக்களைக் கொண்ட தனிமத்துடனோ அல்லது வேறு வகையான அணுக்களைக் கொண்ட தனிமத்துடனோ இணைவகை அத்தனிமத்தின் இணைதிறனே நிர்ணயம் செய்கிறது.
இணைதிறன் ஒன்று என்ற மதிப்பினைப் பெற்ற தனிமங்கள் ஒரு இணைதிறன் தனிமம். (எ.கா) ஹைட்ரஜன் மற்றும் சோடியம். இணைதிறன் – இரண்டு என்ற மதிப்பினைப் பெற்ற தனிமங்கள் இரு – இணைதிறன் தனிமம். (எ.கா) ஆக்ஸிஜன் மற்றும் பெரிலியம். இணைதிறன் – மூன்று என்ற மதிப்பினைப் பெற்ற தனிமங்கள் மூன்று – இணைதிறன் தனிமம். (எ.கா) நைட்ரஜன் மற்றும் அலுமினியம். சில தனிமங்கள் ஒன்றுக்கும் மேற்பட்ட இணைதிறனைப் பெற்றிருக்கும். எடுத்துக்காட்டாக, இரும்பு ஆக்ஸிஜனுடன் இணைந்து இரு வகையான ஆக்ஸைடுகளை உருவாக்கும்.
- பெர்ரஸ் ஆக்ஸைடு வெளிப்படுத்தும் இணைதிறன்.
- மற்றும் பெர்ரிக் ஆக்ஸைடு வெளிப்படுத்தும் இணைதிறன்.
- எனினும், இவற்றைப் பற்றி – விரிவாக உயர் வகுப்புகளில் கற்க இருக்கிறீர்கள்.
தனிமங்கள் – அவற்றின் குறியீடு, அணு எண், நிறை எண் மற்றும் இணைதிறன்
| தனிமம் | குறியீடு | அணு எண் | நிறை எண் | இணைதிறன் |
| ஹைட்ரஜன் | H | 1 | 1 | 1 |
| கார்பன் | C | 6 | 12 | 4 |
| ஆக்ஸிஜன் | O | 8 | 16 | 2 |
| சோடியம் | Na | 11 | 23 | 1 |
பல்வேறு தனிமங்களின் அணுக்கள் இணையும்போது சேர்மங்களின் மூலக்கூறு உருவாகிறது. இந்நிகழ்வுகளில் நாம் அத்தனிமங்களின் இணைத்திறன் மதிப்பினை அறிந்து வைத்திருப்பது அவசியமாகும்.
2Na + Cl2 ———- 2NACl
இணைத்திறன் 1 + 1
இங்கு சோடியம் மற்றும் குளோரினின் இணைத்திறன் 1 ஆகும்.
சோடியம் தனிமத்தின் இணைதிறன் 1.
குளோரின் தனிமத்தின் இணைதிறன் 2.
எனவே இதன் மூலக்கூறு வாய்ப்பாடு
தனிமங்களின் குறியீடு NaCl மூலக்கூறு வாய்ப்பாடு
2Mg + Cl2 ———- MgCl2
இங்கு மெக்னீசியத்தின் இணைதிறன் 2 மற்றும் குளோரினின் இணைதிறன் 1 ஆகும்.
நினைவில் கொள்க:
- ஒரு தனிமத்தின் வேதிப் பண்புகளை தக்க வைத்துக் கொள்ளத்தக்க மிகச் சிறிய துகளே அணுவாகும்.
- மற்ற துகள்களுடன் ஒப்பீடும்போது அவை அளவில் சிறியதாகும்.
- அணுக்களை மிகச் சிறியதாக இருப்பதால் வெறும் கண்களால் மட்டுமல்ல அவற்றினை நுண்ணோக்கியினாலும் காண இயலாது.
- ஓர் அணுவில் மிகப் பெரும்பான்மையான இடம் வெற்றிடமாகும்.
- ஒரே தனிமத்தின் அனைத்து அணுக்களும் ஒரே மாதிரியாகவும் வெவ்வேறு தனிமங்களின் அணுக்கள் வெவ்வேறு மாதிரியாகவும் காணப்படும்.
- ஓர் அணுவில் நேர்மின்சுமை கொண்ட புரோட்டான்களும், மின்சுமையற்ற நியூட்ரான்களும் இணைந்து செறிவான உட்கரு கொண்டிருக்கும்.
- புரோட்டான்களும் நியூட்ரான்களும் இணைந்து நியூக்களியான்கள் என அழைக்கப்படுகின்றன.
- புரோட்டான்கள், நியூட்ரான்கள் மற்றும் எலக்ட்ரான்கள் முறையே p,n,e என்ற குறியீடுகளால் குறிக்கப்படுகின்றன.
- ஓர் அணுவானது மின்சுமையற்றது அதாவது நடுநிலைத்தன்மை உடையது. அணுவில் சம எண்ணிக்கையிலான புரோட்டான்களும் எலக்ட்ரான்களும் காணப்படும்.
- ஓர் அணுவில் உள்ள புரோட்டான்களின் எண்ணிக்கை அத்தனிமத்தின் அணு எண்ணாகும்.
- ஓர் அணுவில் உள்ள புரோட்டான்கள் மற்றும் நியூட்ரான்களின் மொத்த எண்ணிக்கை அத்தனிமத்தின் நிறை எண் எனப்படும்.
- ஒரு தனிமம் மற்ற தனிமங்களுடன் இணையும் திறன் இணைதிறன் எனப்படும்
உங்களுக்கு தெரியுமா?
- நானோமீட்டர் என்பது சிறிய நீளங்களை அளக்க பயன்படும் அலகாகும். ஒரு மீட்டர் என்பது 1 x 10-9 nm அல்லது ஒரு நானோமீட்டர் என்பது 1 x 10-9 m ஆகும்.
- ஒவ்வொரு வருடமும் நமது உடம்பில் உள்ள செல்கள் 98% செல்கள் இறந்து புது செல்கள் தோற்றுவிக்கப்படுகின்றன. இருந்த போதிலும் நமது உடம்பில் ஏறத்தாழ ஏழு பில்லியன் செல்கள் காணப்படுகின்றன.
- அணுக்களைப் பிணைத்திருப்பது எது?
எலக்ட்ரான்கள் எதிர்மின் சுமை கொண்டது; புரோட்டான்கள் நேர்மின்சுமை கொண்டது. இவற்றின் இடையே உள்ள ஈர்ப்பே எலக்ட்ரான்களை அதன் வட்டப்பாதைகளில் பிணைத்து வைக்கிறது.