வேதிவினைகளின் வகைகள் Notes 10th Science Lesson 10 Notes in Tamil
வேதிவினைகளின் வகைகள் Notes 10th Science Lesson 10 Notes in Tamil
அறிமுகம்:
நீங்கள் ஏற்கனவே கற்றறிந்தது போல் ஒரு வேதிவினையில் பழைய பிணைப்புகள் உடைந்து புதிய வேதிப்பிணைப்புகள் உருவாகின்றன. இது தன்னிச்சையாகவோ அல்லது வெளிப்புற ஆற்றல் அல்லது உந்துதல் மூலமாகவோ நடைபெறலாம். வேதியியல் என்பது முழுவதும் வேதிவினைகளை பற்றியதாகும். உங்களுடைய அன்றாட வாழ்வில் பல்வேறு வேதிவினைகளை காண இயலும். மனித இனம் மற்றும் சுற்றுச்சூழல் நலன் பேணுதல் பொருட்டு, இத்தகைய வினைகள் பற்றிய தெளிவான புரிதல் இன்றியமையாதது. எனவே வேதியியல் வேதி வினைகளை முதன்மையாக விளக்குகிறது. நாம் கீழ்காணும் வினாக்களுக்கு விடையளிக்க முயற்சிப்போம்.
- விளையாடுதல், நடத்தல், ஓடுதல் மற்றும் பல்வேறு உடற்திறன் சார்ந்த செயல்களுக்கு ஆற்றல் எதிலிருந்து பெறுகிறீர்கள்?
- எவ்வாறு தாவரங்கள் வளர்கின்றன மற்றும் உணவைப் பெறுகின்றன?
- ஒரு கார் எரி பொருளைக் கொண்டு எவ்வாறு இயங்குகிறது?
- நீர் அல்லது காற்றுடன் தொடர்பு கொள்ளும் பொழுது இரும்பு ஏன் துருப்பிடிக்கிறது?
நீங்கள் உண்ணும் உணவு செரிமானம் அடைவதன் மூலம் ஆற்றலைப் பெறுகிறீர்கள். தாவரங்கள் பூமியிலிருந்து ஊட்டச்சத்துக்களை உறிஞ்சி வளர்கின்றன. மேலும் ஒளிச்சேர்க்கையின் மூலம் உணவை பெறுகின்றன. எரிபொருள் எரிவதால் கார் இயங்குகிறது. இரும்பு ஆக்சிஜனேற்றமடைவதால் துருப்பிடிக்கிறது. எனவே இவ்வனைத்துச் செயல்களும் வேதி மாற்றங்களாகும். அதாவது மாற்றத்திற்கு உட்படும் பொருள்கள் அனைத்தும் வேறு புதிய பொருள்களாக மாற்றப்படுகின்றன. எடுத்துக்காட்டு:பெட்ரோல் எரியும்போது அதில் அடங்கியுள்ள ஹைட்ரோகார்பன்கள், கார்பன் டைஆக்சைடு மற்றும் நீராக மாற்றப்படுகின்றன. இப்பாடத்தில் வேதி வினைகளின் தன்மை மற்றும் வகைகளை விவாதிப்போம்.
ஒரு வேதிவினை நடைபெறும் பொழுது நிகழ்வதென்ன?
- ஒரு வேதிவினையில் ஈடுபடும் மூலக்கூறுகளின் அணுக்கள் அல்லது தனிமங்கள் மாற்றியமைக்கப்பட்டு புதிய மூலக்கூறுகள் உருவாகின்றன.
- அணுக்களுக்கிடையேயான பிணைப்புகள் உடைந்து புதிய வேதிப் பிணைப்புகள் உருவாகின்றன.
- பிணைப்பு உடையும் பொழுது ஆற்றல் உறிஞ்சப்படுகிறது. அதேபோன்று பிணைப்பு உருவாகும் போது ஆற்றல் வெளிப்படுகிறது. (உமிழப்படுகிறது).
வேதிவினைகள் எவ்வாறு குறிக்கப்படுகின்றன?
மீத்தேன் ஆக்சிஜனுடன் வினைபுரிந்து கார்பன் டைஆக்சைடு மற்றும் நீரைத் தருகிறது. இவ்வினையை எவ்வாறு குறிப்பிடுவாய்?
இவ்வினையினை வார்த்தை சமன்பாடாக கீழ்க்கண்டவாறு குறிக்கலாம்.
மீத்தேன் + ஆக்சிஜன் ???? கார்பன் டைஆக்சைடு + நீர்
இச்சமன்பாடானது வினைபடுபொருள், வினை விளைபொருள்களின் வேதி இயைபைத் தருவதில்லை. எனவே ஒரு வேதிவினையின் பண்புகளை பற்றி அறிய அது வேதிச் சமன்பாடாக குறிக்கப்படுகிறது. ஒரு வேதிவினையில் ஈடுபடும் வேதிப்பொருள்கள் அவற்றின் வேதிவாய்பாடுகளால் குறிக்கப்படுகின்றன. வினையில் ஈடுபடும் தனிமங்கள் அல்லது சேர்மங்கள் (வினைபடு பொருள்கள்) அம்புக்குறியின் இடதுபுறமும், வினையில் உருவாகும் பொருள்கள் (வினைவிளை பொருள்கள்) அம்புக்குறியின் வலப்புறமும் குறிக்கப்படுகின்றன. அம்புக்குறியானது வினை நிகழும் திசையைக் குறிக்கிறது. இவ்வாவறாக மேற்கூறிய வினையை பின்வருமாறு எழுதலாம்.
CH4 + O2 ???? CO2 + H2O
ஆனால் இதுவும் கூட முழுமையற்ற வேதிச் சமன்பாடாகும் ஏனெனில் பொருண்மை அழியா விதிப்படி பொருண்மையை ஆக்கவோ அழிக்கவோ முடியாது. ஒரு வேதி வினையின் மூலம் புதிய அணுக்களை நாம் உருவாக்க இயலாது. மாறாக வேதி வினை மூலம் பல்வேறு வழிகளில் அணுக்களை மாற்றியமைத்து புதிய சேர்மத்தினை உருவாக்கலாம். எனவே ஒரு வேதிச் சமன்பாட்டில் வினைபடு பொருள்களின் அணுக்களின் எண்ணிக்கையும், வினை விளை பொருள்களிலுள்ள அணுக்களின் எண்ணிக்கையும் சமமாக இருக்க வேண்டும். மேற்கண்ட சமன்பாட்டில் ஹைட்ரஜன் மற்றும் ஆக்சிஜன் அணுக்களின் எண்ணிக்கை சமமாக இல்லை. இதனை சரி செய்யும்பொழுது கீழ்க்கண்ட சமன்படுத்தப்பட்ட சமன்பாடு கிடைக்கிறது.
CH4 + 2O2 ???? CO2 + 2H2O
மேலும் ஒரு வேதிச் சமன்பாடானது அவ்வினையில் ஈடுபடும் பொருள்களில் இயல்புநிலையையும், வினை நடைபெறும் சூழ்நிலைகளைப் பற்றிய விவரத்தையும் தருகிறது.
CH4(g) + 2 O2(g) ???? CO2(g) + 2H2O(g)
மீத்தேன் ஆக்சிஜன் கார்பன் டைஆக்சைடு நீர்
வேதிவினைகளின் வகைகள்:
அணுக்களின் மறுசீரமைப்பு தன்மையைப் பொறுத்து வகைப்படுத்துதல்:
இதுவரை நீங்கள், வேதிவினைகள் பற்றியும், அவை எவ்வாறு வேதிச் சமன்பாடாகக் குறிக்கப்படுகின்றன என்றும் கற்றறிந்தீர்கள். ஒவ்வொரு நாளும் அதிக எண்ணிக்கையிலான வேதிவினைகள் நம்மைச் சுற்றி நடக்கின்றன. அவை எல்லாம் ஒரே வகையாக நடக்கின்றனவா? இல்லை. ஓவ்வொரு வினையும் பல்வேறு வகையான அணுக்களை உள்ளடக்கியது. எனவே அவை வினைபடும் விதமும் வேறுபடுகிறது. எனவே ஒரு வினையில் ஈடுபடும் வினைபடு பொருளின் அணுக்கள் எவ்வாறு மாற்றியமைக்கப்படுகின்றன என்பதன் அடிப்படையில் வேதிவினைகளை பின்வருமாறு வகைப்படுத்தப்படுகிறது.
அ. சேர்க்கை அல்லது கூடுகை வினைகள்:
இரண்டு அல்லது அதற்கு மேற்பட்ட வினைபடு பொருள்கள் இணைந்து ஒரு சேர்மம் உருவாகும். வினை சேர்க்கை அல்லது கூடுகை வினை ஆகும். இதனை “தொகுப்பு வினை” அல்லது “இயைபு வினை” என்றும் அழைக்கலாம். ‘A’ மற்றும் ‘B’ இணைந்து “AB” என்ற சேர்மம் உருவாக்கும். சேர்க்கை வினையின் பொதுவான வடிவம் கீழே கொடுக்கப்பட்டுள்ளது.
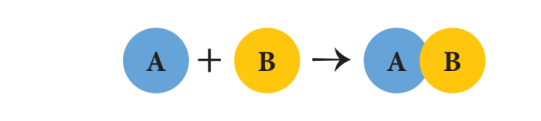
எடுத்துக்காட்டு: ஹைட்ரஜன் வாயு குளோரினுடன் இணைந்து ஹைட்ரஜன் குளோரைடு வாயுவை தருகிறது.
H2(g) + CL2(g) ???? 2HCI(g)
வினைபடு பொருளின் தன்மையைப் பொருத்து சேர்க்கை வினைகள் “மூன்று வகைகளாக” பிரிக்கப்படுகின்றன.
- தனிமம் + தனிமம் ???? சேர்மம்
இந்த வகை சேர்க்கை வினைகளில், இரண்டு தனிமங்கள் ஒன்றோடொன்று இணைந்து ஒரு சேர்மத்தைத் தருகின்றன. இவ்வகை வினைகள் உலோகம் மற்றும் அலோகங்களுக்கிடையே அல்லது இரண்டு அலோகங்களுக்கிடையே நடைபெறலாம்.
எடுத்துக்காட்டு 1: திட கந்தகம் (சல்பர்) ஆக்சிஜனுடன் வினை புரிந்து கந்தக டைஆக்சைடு உருவாகிறது. இவ்வினையின் இரு வினைபடு பொருள்களும் அலோகங்கள் ஆகும்.
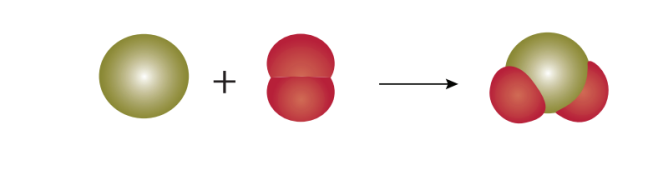
S(g) + O2(g) ???? SO2(g)
எடுத்துக்காட்டு 2: வெள்ளி போன்ற வெண்மையான சோடியமானது வெளிறிய பச்சை கலந்த மஞ்சள் வாயுவான குளோரினுடன் இணையும் போது, உண்ணத் தகுந்த சோடியம் குளோரைடைத் தருகிறது. இங்கு வினைபடு பொருள்களில், ஒன்று உலோகம் (சோடியம்), மற்றொன்று அலோகம் (குளோரின்) ஆகும்.
2Na(S) + Cl2(g) ???? 2NaCl(S)
சோதிக்க:
பின்வரும் அட்டவணையில் கொடுக்கப்பட்ட உலோகங்கள் மற்றும் அலோகங்கள் இடையே சாத்தியமான கூடுகை வினை அல்லது சேர்க்கை வினைகளை கண்டறிந்து அவற்றின் சமன் செய்யப்பட்ட வினைகளை (சமன்பாட்டை) எழுதுங்கள்.
| உலோகங்கள் | அலோகங்கள் |
| Na, K, Cs, Ca, Mg | F, Cl, Br, I |
- சேர்மம் + தனிமம் ???? சேர்மம்
இவ்வகை சேர்க்கை வினையில், ஒரு சேர்மம் மற்றொரு தனிமத்துடன் சேர்ந்து ஒரு புதிய சேர்மத்தை தருகிறது.
எடுத்துக்காட்டு: பாஸ்பரஸ் டிரை குளோரைடு, குளோரினுடன் இணைந்து பாஸ்பரஸ் பெண்டா குளோரைடைத் தருகிறது.
PCl3(I) + Cl2(g) ???? PCl5(s)
- சேர்மம் + சேர்மம் ???? சேர்மம்
இச்சேர்க்கை வினையில் இரண்டு சேர்மங்கள் சேர்ந்து ஒரு புதிய சேர்மத்தை உருவாக்குகின்றன. பின்வரும் வினையில் சிலிக்கான் டை ஆக்சைடு, கால்சியம் ஆக்சைடுடன் வினைபுரிந்து கால்சியம் சிலகேட்டைத் தருகிறது.
SiO2(S) + CaO(S) ???? CaSiO3(S)
இயற்கையில் நிகழும் பெரும்பாலான சேர்க்கை வினைகள் வெப்ப உமிழ் வினைகளாகும். ஏனெனில், இங்கு புதிய பிணைப்புகள் உருவாக்கப்படுவதால், அதிக ஆற்றல் வெப்பமாக வெளியிடப்படுகிறது.
ஆ. சிதைவு வினைகள்:
தகுந்த சூழ்நிலையில் ஒரு சேர்மம் சிதைவுற்று இரண்டு அல்லது அதற்கு மேற்பட்ட எளிய மூலக்கூறுகளாக சிதைவுறும் வினை சிதைவுவினை எனப்படும். இவ்வினை சேர்க்கை வினைக்கு எதிர்வினை ஆகும். ஒரு சிதைவு வினையின் பொதுவான வடிவம் கீழே தரப்பட்டுள்ளது.

சிதைவு வினையின் ஒரு முக்கிய நிகழ்வு, பிணைப்புகள் உடைவதேயாகும். எனவே இவ்வினையின் போது பிணைப்புகள் உடைய ஆற்றல் தேவைப்படுகிறது. அவ்வாறு பயன்படுத்தப்படும் ஆற்றலின் இயல்பை பொருத்து சிதைவு வினைகள் மூன்று வகைகளாகப் பிரிக்கப்படுகின்றன.
- வெப்பச் சிதைவு வினைகள்.
- மின்னாற் சிதைவு வினைகள்.
- ஒளிச் சிதைவு வினைகள்.
- வெப்பச் சிதைவு வினைகள்:
இவ்வகை வினையில் வினைபடுபொருள் வெப்பத்தினால் சிதைவுறுகிறது.
எடுத்துக்காட்டு: மெர்குரி (II) ஆக்ஸைடு வெப்பத்தினால் சிதைவுற்று மெர்குரி மற்றும் ஆக்சிஜன் வாயுவாக மாறுகிறது. வெப்பத்தை எடுத்துக் கொண்டு இவ்வினை நிகழ்வதால் இது வெப்பச் சிதைவு வினை எனப்படுகிறது. மேலும் இவ்வினை, சேர்மத்திலிருந்து தனிமம்/தனிமம் சிதைவடைதல் என்ற வகையைச் சார்ந்தது. அதாவது மெர்குரிக் ஆக்ஸைடு, மெர்குரி மற்றும் ஆக்சிஜன் என்ற தனிமங்களாகச் சிதைவடைகிறது.
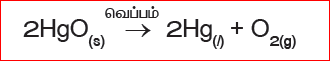
இது போன்று, கால்சியம் கார்பனேட்டை வெப்பப்படுத்தும் போது அது சிதைவுற்று கால்சியம் ஆக்சைடு மற்றும் கார்பன்-டை-ஆக்சைடாக மாறுகிறது. இவ்வினை சேர்மத்திலிருந்து சேர்மம்/சேர்மம் என்ற வகையைச் சார்ந்தது.

வெப்பச்சிதைவு வினைகளில் பிணைப்புகளை உடைப்பதற்கு வெப்பம் தரப்படுகிறது. இது போன்ற வெப்பத்தை உறிஞ்சும் வினைகளை “வெப்பகொள் வினைகள்” எனலாம்.
- மின்னாற் சிதைவு வினைகள்:
சில சிதைவு வினைகளில் மின்னாற்றல் வினையை நிகழ்த்தப் பயன்படுகிறது. எடுத்துக்காட்டாக சோடியம் குளோரைடு கரைசலில் மின்னாற்றலை செலுத்தும்போது சோடியம் குளோரைடு சிதைவுற்று உலோக சோடியம் மற்றும் குளோரின் வாயு உருவாகின்றன. இந்நிகழ்வு “மின்னாற்பகுப்பு” எனப்படும்.
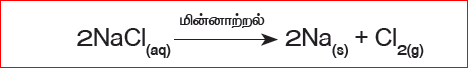
இங்கு சோடியம் குளோரைடு, சோடியம் மற்றும் குளோரின் என்ற தனிமங்களாக மாறுகின்றது. எனவே இது சேர்மத்திலிருந்து தனிமம் – தனிமம் என்ற வகையைச் சேர்ந்தது,
- ஓளிச்சிதைவு வினைகள்:
ஒளியானது சிதைவு வினைகளை நிகழ்த்தும் மற்றொரு வகை ஆற்றல் ஆகும். எடுத்துக்காட்டு: சில்வர் புரோமைடு மீது ஒளி படும்பொழுது, அது சிதைவுற்று சில்வர் உலோகத்தையும், புரோமின் வாயுவையும் தருகிறது. ஒளியானது இச்சிதைவை நிகழ்த்துவதால் இவ்வினை “ஒளிச்சிதைவு” எனப்படும்.

சில்வர் புரோமைடு ஒளிச்சிதைவு
இங்கு மஞ்சள் நிற சில்வர் புரோமைடு சாம்பல் நிற சில்வர் உலோகமாக மாறுகிறது. இதுவும் சேர்மத்திலிருந்து தனிமம் – தனிமம் என்ற சிதைவுறுதல் வகைக்கு எடுத்துக்காட்டாகும்.
இ) ஓற்றை இடப்பெயர்ச்சி வினைகள்:
இவ்வகை வினை ஒரு தனிமம் மற்றும் சேர்மத்திற்கிடையே நிகழ்வதாகும். அவை வினைபடும் பொழுது சேர்மத்திலுள்ள ஒரு தனிமம் மற்றொரு தனிமத்தால் இடப்பெயர்ச்சி அடைந்து புதிய சேர்மத்தையும், தனிமத்தையும் தருகிறது. ஓற்றை இடப்பெயர்ச்சி வினைகளின் பொதுவான வடிவம் வருமாறு:
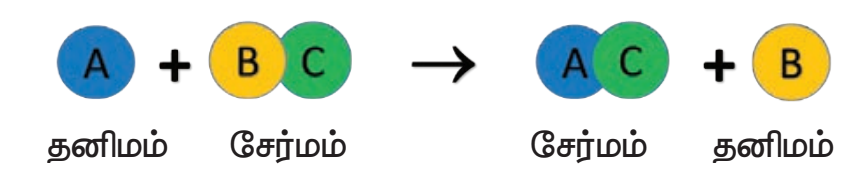
தனிமம் ‘A’ ஆனது ‘B’ என்ற தனிமத்தை அதனுடைய சேர்மமான ‘BC’யிலிருந்து இடப்பெயர்ச்சி செய்கிறது. எனவே இது ஒற்றை இடப்பெயர்ச்சி வினை எனப்படுகிறது.
துத்தநாக உலோகத்தை ஹைட்ரோகுளோரிக் அமிலத்தில் வைக்கும் பொழுது ஹைட்ரஜன் வாயு வெளிவருகிறது. இங்கு ஹைட்ரஜன் துத்தநாகத்தால் இடப்பெயர்ச்சி செய்யப்பட்டு துத்தநாக குளோரைடு உருவாகிறது.
Zn(S) + 2HCl(l) ???? ZnCl2(l) + H2(g)
Fe(S) + CuSO4(aq) ???? FeSO4(aq) + Cu(S)
படத்தில் காட்டியுள்ளபடி காப்பர் (II) சல்பேட்டின் நீர்க்கரைசலில் ஒரு இரும்பு ஆணியை வைக்கும் பொழுது இரும்பு, காப்பரை இடப்பெயர்ச்சி செய்கிறது.

இரும்பு காப்பரை இடப்பெயர்ச்சி செய்தல்
வினைபடுபொருள்களில் வேறுபட்ட சேர்க்கை மூலம் இதுபோன்ற பல்வேறு வினைகளை நாம் முன் வைக்க முடியும். ஆனால் அவையெல்லாம் நடைமுறையில் நடக்குமா? இல்லை. இதனை எளிதாக ஹேலஜன்களை கொண்டு விளக்க முடியும். எடுத்துக்காட்டாக கீழ்க்கண்ட இரு வேதிவினைகளை கருதுவோம்.
2NaCl(aq) + F2(g) ???? 2NaF(aq) + Cl2(g)
2NaF(ag) + Cl2(g) ???? 2NaCl(aq) +F2(g)
முதல் வினையில் சோடியம் குளோரைடிலிருந்து குளோரின் புளுரினால் இடப்பெயர்ச்சி செய்யப்படுகிறது. இரண்டாம் வினையில் குளோரின், புளுரினை சோடியம் புளுரைடிலிருந்து இடப்பெயர்ச்சி செய்கிறது.
மேற்கண்ட இரண்டு வினைகளில் இரண்டாம் வினை நடக்க இயலாது. ஏனெனில் குளோரினை விட புளுரின் வினைதிறன் மிக்கது. மேலும் தனிம வரிசை அட்டவணையில் குளோரினுக்கு மேலே உள்ளது. எனவே இடப்பெயர்ச்சி வினைகளில், தனிமங்களின் வினைதிறன் மற்றும் தனிம வரிசை அட்டவணையில் அவற்றின் இடம் ஆகியவை வினை நடைபெறுவதை தீர்மானிக்கும் முக்கிய காரணிகளாக இருக்கின்றன. அதிக வினைதிறன் கொண்ட தனிமங்கள் குறைந்த வினைதிறன் கொண்ட தனிமங்களை அவற்றின் கரைசலிருந்து இடப்பெயர்ச்சி செய்கின்றன.
சில தனிமங்களின் வினைதிறன் வரிசை கீழே தரப்பட்டுள்ளது.
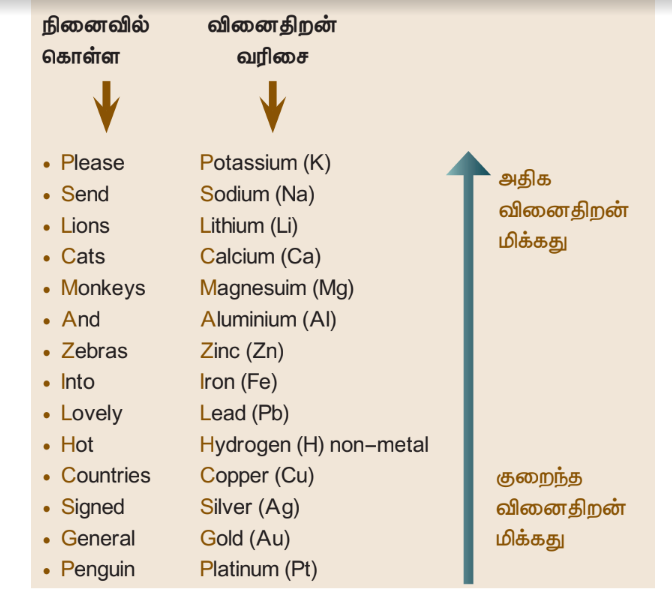
மேற்கண்ட வினைதிறன் வரிசையை தொடர்புடுத்தி கீழ்கண்ட வினாக்களுக்கு விடையளிக்க முயற்சி செய்.
எந்த உலோகங்கள் ஹைட்ரஜனை ஹைட்ரோகுளோரிக் அமிலத்திலிருந்து இடப்பெயர்ச்சி செய்யும்? வெள்ளியா? துத்தநாகாமா? இதற்கான வேதிவினைகளை எழுதி உனது விடையை நியாயப்படுத்துக.
ஈ. இரட்டை இடப்பெயர்ச்சி வினை:
இரண்டு சேர்மங்கள் வினைபுரியும் பொழுது அவற்றின் அயனிகள் பரிமாறிக் கொள்ளபடுமானால் அவ்வினை இரட்டை இடப்பெயர்ச்சி எனப்படுகிறது. ஒரு சேர்மத்தின் அயனி மற்றொரு சேர்மத்தின் அயனியால் இடப்பெயர்ச்சி செய்யப்படுகிறது. ஒரே மாதிரி மின் சுமைகள் கொண்ட அயனிகள் பாமாறிக் கொள்ளப்படுகின்றன. அதாவது ஒரு நேர் அயனி மற்றொரு நேர் அயனியால் இடப்பெயர்ச்சி செய்யப்படுகிறது. இத்தகைய வினை “மெட்டாதிஸிஸ் வினை” எனவும் அழைக்கப்படுகிறது. இரட்டை இடப்பெயர்ச்சி வினையை பின்வருமாறு குறிப்பிடலாம்.
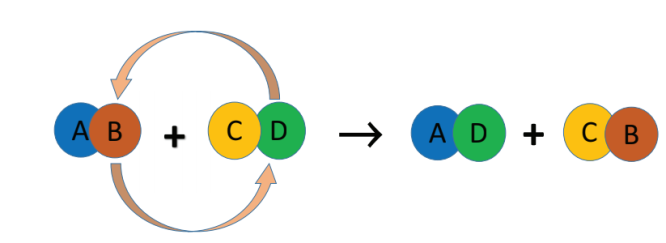
ஒரு இரட்டை இடப்பெயர்ச்சி வினை நடைபெறுவதற்கு, வினைவிளை பொருள்களில் ஒன்று வீழ்படிவாக இருக்க வேண்டும் அல்லது நீராக இருக்க வேண்டும். இவ்வாறாக இரு வகையான இடப்பெயர்ச்சி வினைகள் உள்ளன. அவையாவன:
- வீழ்படிவாக்கல் வினை.
- நடுநிலையாக்கல் வினை.
சேர்க்கை வினைக்கும், சிதைவு வினைக்கும் இடையே உள்ள வேறுபாடுகள்
| சேர்க்கை வினைகள் | சிதைவு வினைகள் |
| ஒன்று அல்லது அதற்கு மேற்பட்ட வினைபடுபொருள்கள் சேர்ந்து ஒற்றை வினை பொருளைத் தரும் | ஒற்றை வினைபடு பொருள், ஒன்று அல்லது அதற்கு மேற்பட்ட விளை பொருளாக சிதைக்கப்படுகிறது. |
| ஆற்றல் உமிழப்படுகிறது | ஆற்றல் உறிஞ்சப்படுகிறது |
| வினைபடு பொருள்கள் தனிமங்களாகவோ, சேர்மங்களாகவோ இருக்கலாம் | வினைபடுபொருள் ஒற்றை சேர்மமாகும் |
- வீழ்படிவாக்கல் வினைகள்:
இரு சேர்மங்களின் நீர்க்கரைசல்களை கலக்கும் பொழுது, அவை வினைபுரிந்து நீரில் கரையாத ஒரு விளைபொருளும், நீரில் கரையும் ஒரு விளைபொருளும் தோன்றினால் அவ்வினை வீழ்படிவாக்கல் வினை எனப்படும். ஒரு விளைபொருள் வீழ்படிவாக இருப்பதால் இவ்வகை வினை வீழ்படிவாக்கல் வினை எனப்படுகிறது.
எடுத்துக்காட்டாக பொட்டாசியம் அயோடைடு மற்றும் லெட் நைட்ரேட்டின் தெளிவான நீர்க்கரைசல்களைக் கலக்கும் பொழுது ஒரு இரட்டை இடப்பெயர்ச்சி வினை நடக்கிறது.
Pb(NO3)2(aq) + 2Kl(aq) ???? Pbl2(S) + 2KNO3(aq)
இங்கு பொட்டாசியமும் லெட் உலோகமும் ஒன்றையொன்று இடப்பெயர்ச்சி செய்துகொண்டு மஞ்சள் நிற லெட் அயோடைடு சேர்மத்தை தருகின்றன.

Pbl2 வீழ்படிவதால்
- நடுநிலையாக்கல் வினைகள்:
உங்களுடைய முந்தைய வகுப்புகளில் ஒரு அமிலமும், காரமும் எவ்வாறு வினைபடுகின்றன என்பதை கற்றிருக்கிறீர்கள். இது இடப்பெயர்ச்சி வினைக்கு மற்றொரு எடுத்துக்காட்டாகும். இங்கு ஒரு அமிலமும், காரமும் வினைபுரிந்து உப்பும் நீரும் கிடைக்கின்றன. இவ்வினை நடுநிலையாக்கல் வினை எனப்படுகிறது. ஏனெனில் அமிலமும், காரமும் ஒன்றை யொன்று நடுநிலையாக்கிக் கொள்கின்றன.
அமிலம் + காரம் ???? உப்பு + நீர்
சோடியம் ஹைட்ராக்ஸைடு மற்றும் ஹைட்ரோ குளோரிக் அமிலத்திற்கு இடையேயான வினை நடுநிலையாக்கல் வினைக்கு ஒரு எடுத்துக்காட்டாகும். இங்கு சேடியம், ஹைட்ரஜனை ஹைட்ரோகுளோரிக் அமிலத்திலிருந்து இடப்பெயர்ச்சி செய்கிறது. இதன் விளைவாக சோடியம் குளோரைடு என்ற நடுநிலையான நீரில் கரையும் உப்பு கிடைக்கிறது.
NaOH(aq) + HCl(aq) ???? NaCl(aq) + HO(i)
இதேபோல் அம்மோனியம் ஹைட்ராக்சைடு என்ற காரம் நைட்ரிக் அமிலத்துடன் வினைபுரியும் பொழுது அம்மோனியம் நைட்ரேட் என்ற உப்பும், நீரும் கிடைக்கிறது.
NH4OH(aq) + HNO3(aq) ???? NH4NO3(aq) + H2O(I)
உ. எரிதல் வினைகள்:
ஒரு எரிதல் வினையில், வினைபடு பொருள் மிகவும் விரைவாக ஆக்சிஜனுடன் சேர்ந்து எரிந்து ஒன்று அல்லது பல ஆக்சைடுகளையும் வெப்ப ஆற்றலையும் தருகின்றன. எனவே ஒரு எரிதல் வினையின் வினைபடு பொருள்களில் ஒன்று ஆக்சிஜனாகும். பெரும்பான்மையான எரிதல் வினைகள் வெப்ப ஆற்றல் மூலங்களாக நம்முடைய அன்றாட வாழ்வின் செயல்பாடுகளில் பயன்படுகின்றன. எடுத்துக்காட்டாக நம்முடைய வீடுகளில் சமைக்க LPG எனப்படும் திரவமாக்கப்பட்ட பெட்ரோலிய வாயுவைப் பயன்படுத்துகிறோம். LPGன் பகுதிப்பொருள்கள் ஆக்சிஜனோடு சேர்ந்து எரிவதால் வெப்பமும், தீச்சுவாலையும் உண்டாகின்றன. LPG என்பது புரோப்பேன், பியூட்டேன் மற்றும் புரோப்பலீன் போன்ற ஹைட்ரோகார்பன் வாயுக்களின் கலவையாகும். அனைத்து ஹைட்ரோ கார்பன்களும் ஆக்சிஜனுடன் எரிந்து கார்பன்-டை-ஆக்சைடையும் நீரையும் தருகின்றன.
C3H8(g) + 5O2(g) ???? 3CO2(g) + 4H2O(g) + வெப்பம்
புரோப்பேன்
மேற்கூறிய வினையில் வெப்பம் உருவாவதால் இது ஒரு வெப்ப உமிழ் வினையாகும். ஆக்சிஜன் சேருவதால் இது மேலும் ஆக்சிஜனேற்ற வினையாகும். எனவே எரிதல் வினையை வெப்ப உமிழ் ஆக்சிஜனேற்றம் எனலாம். சுடர் உருவானால் அதனை எரிதல் என்கிறோம்.

LPG வாயு எரிதல்
கீழ்கண்டவற்றுள் எது எரிதல் வினை?
- உணவு செரித்தல்.
- இரும்பு துருப்பிடித்தல்.
எண்ணற்ற வினைகள், இதுவரை நாம் கற்ற ஐந்து வகையான வினைகளில் அடங்கும். இவ்வினைகளை பற்றி மேலும் பல்வேறு விவரங்களை விளக்கமாக உங்களுடைய உயர் வகுப்புகளில் கற்க இருக்கீறீர்கள்.
வினை நடைபெறும் திசையைக் கொண்டு வகைப்படுத்துதல்:
உங்களைச் சுற்றி ஒவ்வொரு நாளும் எண்ணற்ற மாற்றங்கள் ஏற்படுகின்றன என்பது உங்களுக்குத் தெரியும். அந்த மாற்றங்கள் நிரந்தரமானவையா? திரவ நிலையில் உள்ள நீர், திட நிலை பனிக்கட்டியாக உறைகிறது. பனிக்கட்டி உருகி நீராக மாறுகிறது. எனவே உறைதல் என்பது மீள்மாற்றம். இது நிரந்தர மாற்றமல்ல. இது ஒரு இயற்பியல் மாற்றம். இயற்பியல் மாற்றங்கள் மீள்மாற்றங்களாகும். ஆனால் வேதி மாற்றங்கள் மீள்மாற்றங்களாகும். ஆனால் வேதி மாற்றங்கள் மீள்மாற்றங்களா? அதாவது, வினை விளைபொருள்கள் மீண்டும் வினைபடு பொருள்களாக மாறுமா? மரக்கட்டை எரியும் நிகழ்வை எடுத்துக்கொள்வோம் மரத்தில் உள்ள கார்பன் சேர்மங்கள் எரிந்து கார்பன் டை ஆக்சைடு வாயு மற்றும் நீராகவும் மாறுகிறது.
கார்பன்-டை-ஆக்சைடு மற்றும் நீரையும் சேர்த்து மரத்தை மீண்டும் பெற முடியுமா? நம்மால் பெறமுடியாது. எனவே இது ஒரு நிரந்தர மாற்றம் ஆகும். பெரும்பாலான வினைகளில் வினைபடு பொருள்களை, வினைவிளை பொருள்களிலிருந்து பெற இயலாது. ஆனால் சில வேதி வினைகளை மீள் வினைகளாக மாற்றலாம். நமது கைப்பேசி இயங்கத் தேவையான ஆற்றலை, அதில் உள்ள லித்தியம் அயனி மின்கலன், வேதி வினைகள் மூலமாக உண்டாக்குகின்றன. இந்நிகழ்வு மின்னிறக்கம் எனப்படும். கைப்பேசியை மின்னேற்றம் செய்யும்போது இவ்வேதிவினை மீள் வினையாகிறது. எனவே வேதிவினையானது தகுந்த சூழ்நிலையில் மீண்டும் நிகழச் செய்யலாம். எனவே இவ்வினைகள் இரண்டு வகைகளாக வகைப்படுத்தப்படுகின்றன. அவை மீள் வினைகள் மற்றும் மீளா வினைகள் ஆகும்.

விறகு எரிதல், அலைப்பேசியின் மின்கலம் மின்னேற்றம் அடைதல்.
- மீள் வினைகள்:
மீள் வினைகள் என்பவை மீண்டும் நிகழக்கூடிய வினைகள் ஆகும். அதாவது வினைவிளை பொருள்களை, வினைபடு பொருள்களாக மாற்றமுடியும். ஒரு மீள் வினையை கீழ்க்கண்டவாறு குறிக்கலாம்.
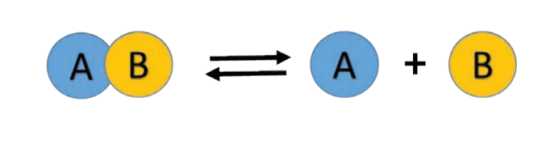
விளக்கம்:
மேற்கண்ட வினையில், வினைபடு பொருள் AB ஆனது சிதைவுற்று வினைவிளைபொருள் ‘A’ மற்றும் ‘B’ கிடைக்கிறது. இது “முன்னோக்கு வினையாகும்.”இவ்வாறு உருவாகும் வினை விளை பொருளான A மற்றும் B மீண்டும் இணைந்து AB என்ற சேர்மமாக மாறுகிறது. இது பின்னோக்கு வினை எனப்படும். ஆகவே இந்த வினை முன்னோக்கு மற்றும் பின்னோக்கு திசைகளில் நடைபெறுகிறது. அப்படியாயின் மேற்கண்ட வினையில் எந்த ஒரு வினைவிளை பொருள்களும் உருவாகவில்லை என்று கருதுகிறாயா? நீ அவ்வாறு கருதினால் அது தவறு. ஏனெனில் வினையானது இரு திசைகளில் நிகழ்ந்தாலும் வினையின் தொடக்கத்தில் அவற்றின் வினைவேகம் சமமானதாக இல்லை.
எ.கா:பாஸ்பரஸ் பென்டா குளோரைடு சிதைவுற்று பாஸ்பரஸ் டிரை குளோரைடு மற்றும் குளோரினைத் தரும் வினையை எடுத்துக்கொள்வோம்.
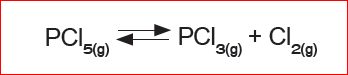
PCl5 சிதைவுறுதல் முன்னோக்குவினையாகவும், PCl3 மற்றும் Cl2 இணைந்து PCl5 உருவாதல் பின்னோக்கு வினையாகவும் நடைபெறுகிறது. முதலில் வினையின் துவக்கத்தில் முன்னோக்கு வினையானது, பின்னோக்கு வினையை விட வேகமாக நடைபெறும். சிறிது நேரத்திற்கு பிறகு முன்னோக்கு மற்றும் பின்னோக்கு வினையின் வேகமானது சமமாகிறது. எனவே பின்னோக்கு வினை நடைபெறுவதால் PCl5 முழுமையாக சிதைவடையாது. இது மீள்வினையாகும். வேதிச் சமநிலையின் போது PCl5-இன் செறிவானது PCl3 மற்றும் Cl2 இன் செறிவை விட அதிகம்.
மீள்வினையின் போது வினைவிளை பொருள்களை அவை உருவான உடனே நீக்குவது மூலமாகவோ அல்லது குறிப்பிட்ட கால இடைவெளியில் வினைபடுபொருள்களை சேர்ப்பதன் மூலமாகவோ அதிக அளவு வினை விளை பொருள்களை பெறமுடியும்.

II. மீளா வினைகள்:
ஒரு வினையில் வினைபடு பொருள்களை மீண்டும் பெற இயலாத வினை “மீளா வினை” எனப்படும். இவ்வினை ஒரே திசையில் மட்டுமே நிகழும். அதாவது முன்னோக்கு வினையாக மட்டுமே நடைபெறும்.
C(S) + O2(g) ???? CO2(g) + வெப்பம்
நிலக்கரி ஆக்சிஜன் கார்பன் டை ஆக்சைடு
நிலக்கரி எரிதல் வினையின் போது கார்பன் டை ஆக்சைடு வாயுவைக் கொடுக்கிறது.
இவ்வினையில் நிலக்கரியானது ஆக்சிஜனுடன் வினைபுரிந்து கார்பன் டை ஆக்சைடு வாயு மற்றும் நீரினை வெளியிடுகிறது. இதில் உருவான கார்பன் டை ஆக்சைடு வாயுவானது மீண்டும், நிலக்கரியாகவும், ஆக்சிஜனாகவும் மாற இயலாது. எனவே இவ்வினை மீளாவினை எனப்படும். அட்டவணையில் மீள்வினை மற்றும் மீளா வினைக்கு இடையேயான வேறுபாடுகள் கொடுக்கப்பட்டுள்ளன.
மீள்வினை மற்றும் மீளா வினைக்கு இடையேயான வேறுபாடுகள்
| மீள்வினை | மீளா வினை |
| தகுந்த சூழ்நிலையில் முன்னோக்கு மற்றும் பின்னோக்கு வினைகள் நடைபெறும் | முன்னோக்கு வினை மட்டும் நடைபெறும் (பின்னோக்கு வினை நடைபெறாது) |
| முன்னோக்கு மற்றும் பின்னோக்கு வினைகள் ஒரே நேரத்தில் நடைபெறும் | ஒரே திசையில் மட்டுமே நடைபெறும் வினை முன்னோக்கு வினையாகும். |
| வினையானது சமநிலையை அடையும் | வினையானது சமநிலையை அடையாது |
| வினைபடு பொருள்கள் முழுவதும் வினைவிளை பொருள்களாக மாற இயலாது | வினைபடு பொருள்கள் முழுவதும் வினைவிளை பொருள்களாக மாறக் கூடியது. |
| இவ்வினை மெதுவாக நடைபெறும் | வேகமாக நடைபெறும். |
இவ்வினைகள் பற்றிய பிற தகவல்களை உங்கள் மேல் வகுப்பில் படிப்பீர்கள்.
வேதிவினையின் வேகம்:
இதுவரை நாம் வேதிவினைகளின் பல்வேறு வகைகளையும், வினைப்படுபொருள்கள், விளைபொருள்களின் இயல்பையும் பற்றி விவாதித்தோம். நாம் கீழ்க்கண்ட வினைகளைக் கருதுவோம்.
- இரும்பு துருப்பிடித்தல்.
- உணவு செரித்தல்.
- பெட்ரோல் எரிதல்.
- பாறைகள் சிதைவடைதல்.
ஓவ்வொரு வினையும் எவ்வளவு வேகமாக நடைபெறுகிறது? மிக மெதுவான வினையிலிருந்து மிக வேகமான வினை வரை வரிசைப்படுத்து? எது மெதுவானது? எது வேகமானது? என்பதை எவ்வாறு நீ தீர்மானிப்பாய்? ஒரு வினை எவ்வளவு வேகமாக நடைபெறுகிறது என்பதைத் தீர்மானிக்கும் வழிகளுள் ஒன்றைப் பற்றி பார்ப்போம். குறித்த காலத்திற்குப் பிறகு ஒரு வேதிவினையில் ஈடுபடும் வினைபடு பொருள்கள், உருவாகும் விளைபொருள்கள் ஆகியவற்றின் அளவைக் கணக்கிடு. எடுத்துக்காட்டாக 100 கிராம் வேதிப்பொருள் வினைக்குட்படுகிறது என்று கருதுவோம். ஒரு மணி நேரத்திற்குப் பிறகு 50 கிராம் ‘A’ மீதமுள்ளது எனக் கொள்வோம்.
A ???? விளைபொருள்
மற்றொரு வகையில் 100 கிராம் ‘C’ என்ற வேதிப்பொருள் வினைப்பட்டு ஒரு மணி நேரத்திற்குப் பிறகு 20 கிராம் ‘C’ எஞ்சியுள்ளது எனக் கொள்வோம்.
C ???? விளைபொருள்
இப்பொழுது அதிவேகமான வினை எதுவென்று உன்னால் கூற இயலுமா? முதல் வினையில் 50கி வினைப்பொருள் விளைபொருளாக மாறியுள்ளது. ஆனால் இரண்டாம் வினையில் 80 கி வினைபடு பொருள் 1 மணி நேரத்தில் விளைபொருளாக மாறியுள்ளது. எனவே இரண்டாவது வினை வேகமாக நடைபெறுகிறது. இந்த அளவீட்டு முறையே வினைவேக முறை எனப்படும்.
“ஒரு வேதி வினையின் வேகம் என்பது ஓரலகு நேரத்தில் ஏதாவது ஒரு வினைபடுபொருள் அல்லது விளைபொருள்களின் அளவு அல்லது செறிவில் ஏற்படும் மாற்றமாகும்”
கீழ்க்கண்ட வினையைக் கருதுவோம்.
A ???? B
இவ்வினையின் வேகம் பின்வருமாறு எழுதுப்படுகிறது.
வேகம் = d[A]/dt = + d[B]/dt
இங்கு [A] என்பது A இன் செறிவாகும்.
[B] என்பது B இன் செறிவாகும்.
“எதிர்க்குறி” நேரத்தைப் பொறுத்து A இன் செறிவு குறைவதைக் காட்டுகிறது.
நேர்க்குறி நேரத்தைப் பொறுத்து Bன் செறிவு கூடுவதைக் காட்டுகிறது.
குறிப்பு [ ] குறி செறிவைக் குறிக்கிறது. ‘d’ என்பது காலத்தைப் பொறுத்து செறிவில் ஏற்படும் மிகச் சிறிய மாற்றத்தைக் குறிக்கிறது.
வினையில் வினையின் வேகம் ஏன் முக்கியத்துவம் பெறுகிறது?
வினை வேகம் அதிகமாக இருக்கும்போது குறிப்பிட்ட நேரத்தில் அதிக அளவு விளைபொருள்கள் கிடைக்கும். எனவே ஒரு வேதியிலாளர்க்கு அதிக அளவு வினை விளை பொருள் பெருவதற்கு வினைவேகம் முக்கியமானதாகும். மேலும் வினைவேகமானது உணவு பதப்படுத்தலில் வினையின் வேகத்தை குறைத்து உணவு கெட்டுபோவதை தவிர்க்க முக்கியமானதாகும்.
வேதிவினைகளின் வேகத்தை பாதிக்கும் காரணிகள்:
ஒரு வினையின் வேகத்தை மாற்ற இயலுமா? வினையின் வேகத்தை மாற்ற இயலும். எ.கா:இரும்பானது துருப்பிடித்தல் நீரில் நடைபெறுவதை விட அமிலத்தில் வேகமாக நடைபெறும், வினையின் வேகத்தை பாதிக்கக் கூடிய முக்கிய காரணிகள்
- வினைபடு பொருள்களின் தன்மை.
- வெப்பநிலை.
- வினையூக்கி.
- அழுத்தம்.
- வினைபடு பொருளின் புறப்பரப்பளவு.
- வினைபடு பொருள்களின் தன்மை:
சோடியம், ஹைட்ரோகுளோரிக் அமிலத்துடன் வேகமாக வினைபுரிகிறது. ஆனால், அசிட்டிக் அமிலத்துடன் மெதுவாக வினைபுரிகிறது. ஏன் என்பது உனக்கு தெரியுமா? ஏனெனில் ஹைட்ரோ குளோரிக் அமிலம், அசிடிக் அமிலத்தை விட வினைதிறன் மிக்கது. எனவே வினைபடுபொருளின் இயல்பு வினைவேகத்தை பாதிக்கிறது.
2Na(S) + 2HCl(aq) ???? 2NaCl(aq) + H2(g) (வேகமாக)
2Na(S) + 2CH3COOH(aq) ???? 2CH3COONa(aq) + H2(g) (மெதுவாக)
- வினைபடு பொருளின் செறிவு:
வினைபடு பொருள்களின் செறிவு அதிகரிக்கும் போது வினைவேகம் அதிகரிக்கிறது. குறிப்பிட்ட கனஅளவு கொண்ட கரைசலில் கரைந்துள்ள கரைபொருளின் அளவே செறிவு ஆகும். செறிவு அதிகமாக இருக்கும் போது குறிப்பிட்ட கனஅளவில் துகள்களின் எண்ணிக்கை அதிகமாக காணப்படும். எனவே வினையின் வேகமும் அதிகரிக்கும்.
துத்தநாக துகள்கள், 1M ஹைட்ரோகுளோரிக் அமிலத்தைவிட 2M ஹைட்ரோகுளேரிக் அமிலத்தில் வேகமாக வினை புரிகின்றது.
- வெப்பநிலை:
வெப்பநிலை உயரும்போது வினையின் வேகமும் அதிகரிக்கும். ஏனெனில் வெப்பம் அதிகரிக்கும் போது வினைபடுபொருள்களின் பிணைப்புகள் எளிதில் உடைந்து வினையின் வேகம் அதிகரிக்கிறது. அறை வெப்பநிலையில் கால்சியம் கார்பனேட் மெதுவாக வினைபுரியும் ஆனால் வெப்பப்படுத்தும்போது வினையின் வேகம் அதிகரிக்கும்.
- அழுத்தம்:
வாயுநிலையிலுள்ள வினைபடு பொருள்களில் அழுத்தம் அதிகரிக்கும் போது வினையின் வேகமும் அதிகரிக்கும். ஏனெனில் அழுத்தத்தை அதிகரிக்கும்போது வினைப்படு பொருள்களின் துகள்கள் மிக அருகே வந்து அடிக்கடி மோதலில் ஈடுபடுகின்றன.
- வினையூக்கி:
வினையூக்கி என்பது வினையில் நேரடியாக ஈடுபடாது, ஆனால் அவ்வினையின் வேகத்தை அதிகரிக்கும்.
பொட்டாசியம் குளோரேட்டை சூடுபடுத்தும் போது ஆக்சிஜன் மிகக் குறைவான வேகத்தில் வெளியேறுகிறது. ஆனால் மாங்கனீசு டை ஆக்ஸைடை வினைபடு பொருளுடன் சேர்த்த பிறகு ஆக்சிஜன் வெளியேறும் வேகம் அதிகரிக்கிறது.
- வினைபடு பொருள்களின் புறப்பரப்பளவு:
வேதிவினையில் கட்டியான வினைபடு பொருள்களை விட, தூளாக்கப்பட்ட வினைபடு பொருள்கள் விரைவாக வினைபுரியும்.
எ.கா:கட்டியான கால்சியம் கார்பனேட்டை விட துளாக்கப்பட்ட கால்சியம் கார்பனேட் ஹைட்ரோகுளோரிக் அமிலத்துடன் மிக விரைவாக வினைபுரியும், ஏனெனில் தூளாக்கப்பட்ட கால்சியம் கார்பனேட்டில் புறப்பரப்பளவு அதிகளவு இருப்பதால் வினை வேகமாக நிகழ்கிறது.
சமநிலை:
மீள்வினையில் முன்னோக்கு வினையும், பின்னோக்கு வினையும் ஒரே நேரத்தில் நடைபெறும். முன்னோக்கு வினையின் வேகமும், பின்னோக்கு வினையின் வேகமும் சமமாக இருக்கும் போது வினை விளை பொருள்கள் உருவாகாது. இந்த நிலைக்கு சமநிலை என்று பெயர். இந்த நிலையை அடைந்த பிறகு, வினைபடுபொருள் மற்றும் வினைவிளை பொருள்களின் அளவில் மாற்றம் ஏற்படுவது இல்லை. ஒரு வேதிவினையில் எட்டப்படும் சமநிலையே வேதிச் சமநிலை எனப்படும்.
வேதிச் சமநிலை என்பது ஒரு மீள்வேதிவினையின் வினைபடுபொருள் மற்றும் வினை விளைபொருளின் செறிவில் எந்த மாற்றமும் நிகழாத நிலை ஆகும். சமநிலையில்,
முன்னோக்கு வினையின் வேகம் = பின்னோக்கு வினையின் வேகம்.
விளக்கம்:
வினையின் தொடக்கத்தில் முன்னோக்கு வினையின் வேகமானது, பின்னோக்கு வினையின் வேகத்தை விட அதிகம். இருந்தபோதிலும் வினை நடைபெறும் பொழுது வினைபடுபொருளின் செறிவு குறைகிறது மற்றும் வினைவிளைபொருளின் செறிவு அதிகரிக்கிறது. வினைவேகம் என்பது செறிவுக்கு நேர்விகிதத் தொடர்புடையது ஆகையால் முன்னோக்கு வினையில் வினைபடு பொருளின் செறிவு நேரத்தைப் பொருத்து குறைவதால், வினைவேகமும் குறைகிறது. அதேபோல் பின்னோக்கு வினையின் வினைவேகம் அதிகரிக்கிறது.
ஒரு குறிப்பிட்ட நிலையில், இரு வினைகளின் வினைவேகமும் சமமாகின்றன. இந்நிலையில், வினைபடு மற்றும் விளைபொருளின் செறிவு நேரத்தை பொருத்து மாறுவதில்லை. இந்த நிலையை சமநிலை என்கிறோம்.
கால்சியம் கார்பனேட் சிதைந்து கால்சியம் ஆக்சைடாகவும், கார்பன் டை ஆக்சைடாகவும் மாறும் வினையைக் கருதுவோம். இந்த வினை ஒரு மீள்வினை. ஒரு வேதிவினையின் வேகமானது எவ்வளவு விரைவாக அதன் வினைபடு பொருள்களின் அளவு குறைகிறது என்பதை சார்ந்ததாகும். இந்த வினை, ஒரு மூடிய கலனில் நடைபெற்றால் அது வேதிச் சமநிலையை அடையும்.
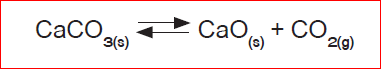
CaCO3 ன் சிதைவு = CaO மற்றும் CO2
வினைவேகம் சேர்க்கை வினையின் வேகம்
வேதியியல் மாற்றங்கள் மட்டுமின்றி இயற்பியல் மாற்றங்களும் சமநிலையை அடைய வல்லது.
மூடிய கலனில் வைக்கப்பட்ட நீரானது, ஆவியாகும் போது நீராவியாக மாறி கலனில் ஒரு அழுத்ததை ஏற்படுத்துகிறது. ஒரு குறிப்பிட்ட நிலையில் நீராவி குளிர்ந்து நீராக மாறுகிறது. இவ்வாறு ஆவி சுருங்கும் வேகமும் நீராவியாக மாறும் வேகமும் சமமாகும்போது, இந்நிகழ்வு சமநிலையை அடைகிறது.
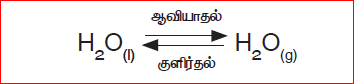
இந்நிலையில் (இரண்டு நிலைகளில்) நீரின் கனஅளவும், நீராவியின் கன அளவும் மாறாது. இது ஒரு இயற்பியல் மாற்றம் ஆகும். எனவே இம்மாற்றத்தில் எட்டப்படும் சமநிலை இயற்பியல் சமநிலை என்று அழைக்கப்டுகிறது. இயற்பியல் சமநிலை என்பது அனைத்து நிலைகளிலும் கனஅளவு மாறாது. (நீராவி, நீர்).

இயற்பியல் சமநிலை
சமநிலையின் பண்புகள்:
- வேதிச் சமநிலையில் முன்னோக்கு வினையின் வேகமும், பின்னோக்கு வினையின் வேகமும் சமம்.
- நேரத்தை பொருத்து அழுத்தம், செறிவு, நிறம், அடர்த்தி, பாகுநிலை போன்றவை மாறாது.
- வேதிச் சமநிலை என்பது ஒரு இயங்குச் சமநிலை ஏனெனில் முன்னோக்கு வினையும், பின்னோக்கு வினையும் தொடர்ந்து நிலையாக நடந்து கொண்டிருக்கும்.
- இயற்பியல் சமநிலையில், அனைத்து நிலைமைகளும் மாறாத கனஅளவைப் பெறுகின்றன.
நீரின் அயனிப் பெருக்கம்:
தூய நீர் ஒரு மின்கடத்தாப் பொருள் என்று பெரும்பாலும் கருதபட்டாலும் துல்லியமான அளவீடுகள் தூய நீர் சிறிதளவு மின்சாரத்தைக் கடத்துகிறது என்பதைக் காட்டுவது கண்டறியப்பட்டுள்ளது. இது நீரின் தன் அயனியாதல் விளைவால் நடைபெறுகிறது. நீரின் சுய அல்லது சுய அயனியாதல் என்பது இரு நீர் மூலக்கூறுகள் இணைந்து அயனிகளைத் தோற்றுவிக்கும் நிகழ்வதாகும். இந்நிகழ்வின்போது ஒரு நீர் மூலக்கூறிலிருந்து ஒரு புரோட்டான் மற்றொரு நீர் மூலக்கூறுடன் சேர்ந்து ஹைட்ரோனியம் அயனியாக கீழ்கண்டவாறு உருவாகிறது.

இவ்வாறு உருவாகும் ஹைட்ரோனியம் அயனி ஒரு வலிமையான அமிலம் ஆகும். ஹைட்ராக்சில் அயனி ஒரு வலிமையான காரம் ஆகும். எனவே அவை உருவானவுடன் மீண்டும் இணைந்து நீரைத் தருகின்றன. இது ஒரு மீள் வினையாகும். மேலும் இவ்வினை விரைவில் சமநிலையை அடைகிறது. எனவே உருவான அயனிகளின் செறிவு மிகக் குறைவாகும். இந்த ஹைட்ராக்சில் மற்றும் ஹைட்ரோனியம் அயனியின் செறிவுகளின் பெருக்குத் தொகையே நீரின் அயனிப்பெருக்கம் எனப்படுகிறது. இது Kw என்றழைக்கப்படுகிறது. இது கணிதச் சமன்பாடாக கீழ்க்கண்டவாறு குறிக்கப்படுகிறது.
Kw = [H3O+] [OH–]
[H3O+] ஐ எளிமையாக [H+] என எழுதலாம். எனவே நீரின் அயனிப் பெருக்கத்தை Kw = [H+] [OH–] என எழுதலாம்.
இதன் அலகு மோல்2 டெசிமீ-6 250C இதன் மதிப்பு 1.00 x 10-14
pH அளவுகோல்:
நீரின் சுய அயனியாதல் பண்பினால் எல்லா நீர்க்கரைசல்களும் ஹைட்ரஜன் மற்றும் ஹைட்ராக்சில் அயனிகளைக் கொண்டிருக்கும். இதனுடன் நீரில் கரைக்கப்படும் சேர்மங்களும் அயனியாதலுக்குட்பட்டு ஹைட்ரஜன் அல்லது ஹைட்ராக்சில் அயனிகளைத் தரலாம். இந்த அயனிகளின் செறிவு ஒரு கரைசலின் அமிலத்தன்மை அல்லது காரத்தன்மையை தீர்மானிக்கிறது.
pH அளவுகோல் ஒரு கரைசலின் ஹைட்ரஜன் அயனிக் செறிவை அளக்க உதவும் ஒரு அளவீடாகும்.
pH என்ற குறியீட்டில், ‘p’ என்பது ‘pontenz’ என்ற ஜெர்மானியச் சொல்லைக் குறிக்கும். இதன் பொருள் Power என்பதாகும். இது டென்மார்க் நாட்டைச் சேர்ந்த உயிரிவேதியியல் விஞ்ஞானி S.P.L.சாரன்சன் என்பவரால் 1909ஆம் ஆண்டு முன்மொழியப்பட்டது. pH அளவீடு என்பது 0 முதல் 14 முடிய உள்ள எண்களைக் கொண்ட அளவீடாகும். இது ஒரு கரைசல் அமிலமா? காரமா? அல்லது நடுநிலைத்தன்மை வாய்ந்ததா என குறிப்பிட உதவுகிறது.
- அமிலங்களின் pH மதிப்பு 7ஐ விட குறைவு.
- காரங்களின் pH மதிப்பு 7ஐ விட அதிகம்.
- நடுநிலைக் கரைசலின் pH மதிப்பு 7க்கு சமம்.
pH என்பதை ஹைட்ரஜன் அயனிச் செறிவின் பத்தை அடிப்படையாகக் கொண்ட மடக்கையின் எதிர் மதிப்பாகும்.
pH = – log10 [H+].
சில பொருள்களின் pH மதிப்பு கீழ்கண்ட அட்டவணையில் தரப்பட்டுள்ளது.
| பொதுவான அமிலங்கள் | pH | பொதுவான காரங்கள் | ||
| HCl (4%) | 0 | இரத்த பிளாஸ்மா | 7.4 | |
| வயிற்றில் (இரைப்பை) உள்ள அமிலம் | 1 | முட்டை வெள்ளைக் கரு | 8 | |
| வினிகர் (அசிட்டிக் அமிலம்) | 3 | சமையல் சோடா | 9 | |
| ஆரஞ்சு பழம் | 3.5 | அமில நீக்கி | 10 | |
| சோடா நீர், திராட்சை | 4 | அம்மோனியா நீர் | 11 | |
| புளித்த பால் | 4.5 | சுண்ணாம்பு நீர் | 12 | |
| தூய பால் | 5 | வடிகால் சுத்தமாக்கும் பொருள் | 13 | |
| மனிதனின் உமிழ்நீர் | 6-8 | எரிசோடா (4% NaOH) | 14 | |
| தூய நீர் | 7 | மெக்னீசியா பால்மம் | 10 | |
| தக்காளிச் சாறு | 4.2 | |||
| காஃபி | 5.6 |
pH தாளைக் கொண்டு ஒரு கரைசலின் pH ஐ எவ்வாறு அளவிடலாம்?
ஒரு கரைசலின் pH மதிப்பினை பொது நிறங்காட்டி ஒன்றின் உதவியால் கண்டறிய முடியும். இந்நிறங்காட்டி சில சாயங்களின் கலவையாகும். இது கரைசலாகவோ அல்லது தாள் வடிவிலோ பயன்படுத்தப்படுகிறது.

pH நிறங்காட்டி
பள்ளி ஆய்வக அளவிலான pH அளவீட்டுக்கு pH தாளை பயன்படுத்துவது ஒரு பொதுவான முறையாகும். ஒரு pH தாள் நிறங்காட்டிகளின் கலவையால் ஆனது. இது கொடுக்கப்பட்ட pHஇல் குறிப்பிட்ட நிறத்தைக் காட்டுகிறது. நிறங்காட்டியின் குடுவையோடு (பாட்டிலோடு) ஒரு நிற வழிகாட்டி தரப்படுகிறது அல்லது நிறங்காட்டி நீள்வடிவ காகிதத்துண்டுகள் தரப்படுகின்றன. ஒரு துளி சோதனை கரைசல் பொது நிறங்காட்டியுடன் சேர்க்கப்பட்டு அல்லது pH தாளில் வைக்கப்பட்டு நிறப்பட்டியலுடன் தொடர்படுத்தி pH மதிப்பு கண்டறியப்படுகிறது. இவ்வாறு கண்டறியப்படும் மதிப்புகள் தோராயமான மதிப்புகளே ஆகும். பொதுவாக மனித ரத்தத்தின் pH மதிப்பு 7.4 ஆகும்.
அன்றாட வாழ்வின் pHன் பங்கு:
தாவரங்களும், விலங்குகளும் pH சார்ந்த உணர்வுள்ளவையா?
நமது உடலானது 7.0 முதல் 7.8 வரை உள்ள pH எல்லை சார்ந்து வேலை செய்கிறது. உயிரினங்கள் ஒரு குறுகிய pH எல்லைக்குள் மட்டுமே உயிர் வாழ இயலும். நம் உடலில் உள்ள திரவங்கள் வெவ்வேறு pH மதிப்புகளைக் கொண்டவை. எடுத்துக்காட்டாக மனித ரத்தத்தின் pH மதிப்பு 7.35 லிருந்து 7.45 ஆகும். இந்த மதிப்பிலிருந்து குறைந்தாலோ அல்லது அதிகரித்தாலோ, அது நோயை உண்டாக்கும்.
மனித செரிமான மண்டலத்தில் மதிப்பு:
நமது இரைப்பை ஹைட்ரோகுளோரிக் அமிலத்தை சுரக்கிறது என்பது ஒரு வியப்பூட்டும் செய்தியாகும். இந்த அமிலம் இரைப்பையை பாதிக்காமல் உணவைச் செரிக்க உதவுகிறது. சரியான செரிமானம் இல்லாதபோது இரைப்பையானது கூடுதலான அமிலத்தைச் சுரந்து வலியையும், எரிச்சலையும் ஏற்படுத்துகிறது. இரைப்பையில் உள்ள திரவத்தின் தோராயமான pH மதிப்பு 2.0 ஆகும்.
pH மாற்றம் – பற்சிதைவுக்குக் காரணம்:
மனித உமிழ்நீரின் pH மதிப்பு 6.5 – 7.5 வரை உள்ளது. நமது பற்களின் மேற்பரப்பு படலமானது கால்சியம் பாஸ்பேட் என்ற மிகக் கடினமான பொருளினால் ஆனது. ஏனெனில் உமிழ்நீரின் pH 5.5க்கும் கீழே குறையும்பொழுது பற்களின் மேற்பரப்பு படலம் (எனாமல்) பாதிக்கப்படுகிறது. இது பற்சிதைவு எனப்படுகிறது. பொதுவாக நாம் பயன்படுத்தப்படும் பற்பசைகள் காரத்தன்மை கொண்டவை. இவை கூடுதல் அமிலத்தன்மையை நடுநிலையாக்கம் செய்து பற்சிதைவைத் தடுக்கின்றன.
மண்ணின்pH:
விவசாயத்திற்கு மண்ணின் pH மிக முக்கியத்துவம் வாய்ந்தது. சிட்ரிக் அமிலம் கொண்ட பழங்கள் சற்று காரத்தன்மை உள்ள மண்ணிலும், நெல் அமிலத்தன்மை கொண்ட மண்ணிலும், கரும்பு நடுநிலைத்தன்மை கொண்ட மண்ணிலும் வளரும்.
மழை நீரின் pH:
மழை நீரின் pH மதிப்பு ஏறக்குறைய 7 ஆகும். இது, மழைநீர் நடுநிலைத்தன்மையானது மற்றும் தூய்மையானது என்பதைக் குறிக்கிறது. வளிமண்டலக் காற்று சல்பர் டை ஆக்சைடு, நைட்ரஜன் ஆக்சைடுகள் ஆகிய வாயுக்களால் மாசுபடும் பொழுது அவை மழைநீரில் கரைந்து pH மதிப்பை 7ஐ விடக் குறையச் செய்கின்றன. இவ்வாறு மழைநீரின் pHஐ விட குறையும் பொழுது அம்மழை அமிலமழை எனப்படுகிறது. இந்த அமிலமழை நீர் ஆறுகளில் சேரும் பொழுது அவற்றின் pHஐ குறைக்கின்றன. இதனால் நீர்வாழ் உயிரிகளின் வாழ்வு பாதிக்கப்படுகிறது.
கணக்கீடுகள்:
pH என்பது ஹைட்ரஜன் அயனி செறிவின் பத்தை அடிப்படையாக கொண்ட மடக்கையின் எதிர் மதிப்பாகும்.
pH = -log10 [H+]
எ.கா: 0.01M HNO3 கரைசலின் pH மதிப்பு காண்க:
தீர்வு:
[H+] = 0.01
pH = -log10 [H+]
pH = -log10 [0.01]
pH = -log10 [1 x 10-2]
pH = -(log101 – 2 log10 10)
pH = 0 + 2 x -log10 10
pH = 0 + 2 x 1 = 2
pH = 2
pOH என்பது ஹைட்ராக்சில் அயனிச் செறிவின் பத்தை அடிப்படையாக கொண்ட மடக்கையின் எதிர் மதிப்பாகும்.
pOH = -log10 [OH–]
எ.கா: ஒரு கரைசலின் ஹைட்ராக்சில் அயனி 1 x 10-9 M செறிவு எனில் அக்கரைசலின் pOH மதிப்பு என்ன?
தீர்வு:
pOH = -log10 [OH–]
pOH = -log10 [1 x 10-9]
pOH = (-log10 1.0 + log10 10-9)
pOH = (0-9 log10 10)
pOH = -(0-9)
pOH = 9
pH மற்றும் pOH க்கு உள்ள தொடர்பு:
ஒரு நீர்க்கரைசலின் pH மற்றும் pOH-க்கு இடையேயான தொடர்பை கீழ்க்கண்ட சமன்பாட்டின் மூலம் அறியலாம்.
pH + pOH = 14
கரைசலின் pH மற்றும் pOH ல் ஏதேனும் ஒரு மதிப்பு தெரிந்தால் மற்றொன்றை எளிதாக கணக்கிடலாம்.
எ.கா: ஒரு கரைசலின் pOH மதிப்பு 11.76 எனில் அக்கரைசலின் pH மதிப்பு காண்க.
pH = 14 – pOH
pH = 14 – 11.76 = 2.24
கணக்குகள்:
எ.கா:1
0.001M செறிவுள்ள ஹைட்ரோ குளோரிக் அமிலத்தின் கரைசலின் pH மதிப்பை காண்க.
தீர்வு:
HCl என்பது வலிமை மிகுந்த அமிலம் என்பதால் முழுவதும் அயனியாக மாறும் கீழ்கண்டவாறு.
HCl(aq) ???? H+(aq)+ Cl–(aq)
மேற்கண்ட செயலில் ஒரு மோல் HCl ஒரு மோல் H+ அயனிகளை தரும். ஆகையால், H+ அயனியின் செறிவானது ஹைட்ரோ குளோரிக் (HCl) அமில செறிவுக்கு சமம். (0.001 M அல்லது 1.0 x 10-3 மோல் லி-1.)
pH = -log10 [H+] = -log10 10-3
= -(-3 x log10 10)
= -(-3 x 1) = 3
pH = 3
எ.கா 2:
5 x 10-5 மோல்-1 செறிவு கொண்ட நீர்த்த சல்பியூரிக் அமிலத்தின் pH மதிப்பு என்ன?
தீர்வு:
நீரில், சல்பியூரிக் அமிலம் பிரியும் முறை.
H2SO4(aq) ???? 2H +(aq) + SO42-(aq)
கரைசலில் ஒவ்வொரு மோல் சல்பியூரிக் அமிலம், இரண்டு மோல் H+ அயனிகளை தரும். ஒரு லிட்டர் H2SO4 கரைசலில் 5 x 10-5 மோல் H2SO4 இருக்கும். 2 x 5 x 10-5 = 10 x 10-5 அல்லது H+ அயனிகளை ஒரு லிட்டரில் 1.0 x 10-4 மோல்.
[H+] = 1.0 x 10-4 மோல் லிட்டர்-1.
pH = -log10[H+]
= -log10 10-4
= -(-4 x log10 10)
= -(-4 x 1) = 4
pH = 4
எ.கா 3:
1 x 10-4 மோல் NaOH கரைசலில் உள்ள pH மதிப்பை காண்க.
தீர்வு:
NaOH என்பது வலிமையான காரம் மற்றும் அக்கரைசலை கீழ்கண்டவாறு பிரிகை அடைகிறது.
NaOH(aq) ???? Na+(aq) + OH-(aq)
ஒரு மோல் NaOH ஆனது ஒரு மோல் OH– அயனிகளை இதிலிருந்து தரும்.
[OH–] = 1 x 10-4 மோல் லிட்டர்-1
pOH = -log10[OH–]
= -log10 [10-4]
= -(-4 x log1010)
= -(-4) = 4
pH + pOH = 14
pH = 14 – pOH
= 14-4
= 10
எ.கா 4:
ஒரு கரைசலின் ஹைட்ரஜன் அயனியின் செறிவு 1 x 10-8 மோல் லி-1 எனில் அக்கரைசலின் pH மதிப்பை காண்க.
தீர்வு:
இங்கு நீர்த்த கரைசலாக உள்ளதால் கொடுக்கப்பட்டுள்ள செறிவானது அமிலத்தையோ, காரத்தையோ குறிப்பது இல்லை. ஆனால் H+ அயனிகளை குறிக்கும். எனவே கீழ்கண்டவாறு கணக்கிடலாம்.
pH = -log10 [H+]
[H+] = 1.0 x 10-8 மோல் லிட்டர்-1
pH = -log10 [10-8]
= -(-8 x log1010)
= -(-8 x 1) = 8
எ.கா 5:
ஒரு கரைசலின் pH மதிப்பு 4.5 எனில் pOH மதிப்பைக் காண்க.
தீர்வு:
pH + pOH = 14
pOH = 14 – pH
pOH = 14 – 4.5 = 9.5
pOH = 9.5
நினைவில் கொள்க:
- வேதி மாற்றம் என்பது ஒன்று அல்லது அதற்கு மேற்பட்ட புதிய பொருள்கள் உருவாகும் ஒரு மாற்றமாகும்.
- பெரும்பாலான சேர்க்கை வினைகள் வெப்ப உமிழ் வினைகளே ஆகும்.
- எல்லா ஒளிச்சிதைவு வினைகள் வெப்பக் கொள்வினைகள் ஆகும்.
- இரட்டை இடப்பெயர்ச்சி பரஸ்பர அயனிகள் பரிமாற்றத்தினால் நிகழ்கின்றன.
- வீழ்படிவு வினைகள் கரையாத உப்பினை விளைபொருளாக தருகின்றன.
- நடுநிலையாக்க வினை என்பது ஒரு அமிலமும், காரமும் சேர்ந்து உப்பையும், நீரையும் தரும் வினையாகும்.
- நடுநிலையாக்கல் வினையால் பற்சிதைவு தடுக்கப்படுகிறது.
- பெரும்பாலான வேதிவினைகள் மீளா வினைகளாகும்.
- வேதிச் சமநிலை – முன்னோக்கு வினையின் வேகமும் பின்னோக்கு வினையின் வேகமும் சமமாக உள்ள நிலை.
- வெப்ப நிலை, வேதி வினையின் வேகத்தை அதிகரிக்கிறது.
- ஒரு மூடிய அமைப்பில் சமநிலை நடைபெற இயலும்.
- அழுத்தம் ஒரு வேதிவினையின் வேகத்தை அதிகரிக்கிறது.
- நம் அன்றாட வாழ்க்கையில் pH முக்கிய பங்கு வகிக்கிறது.
- மனிதர்களில் அனைத்து உயிரி வேதிவினைகளுக்கு pH மதிப்பு 7-7.8 க்கு இடையே நடைபெறும்.
- மழைநீரின் pH மதிப்பு 5.6 க்கு கீழ் செல்லும்போது அது அமில மழை எனப்படும்.
- தூய நீர் ஒரு வலிமை குறைந்த மின்பகுளியாகும்.
உங்களுக்கு தெரியுமா?
“சமன்படுத்தப்பட்ட வேதிச் சமன்பாடு என்பது ஒரு வேதிவினையின் வேதி இயைபு, வினைபடு மற்றும் வினை விளைபொருள்களின் இயற்பியல் நிலைமை மற்றும் வினை நடைபெறும் சூழ்நிலைகளை குறிக்கும் எளிய (குறிப்பு) குறியீடாகும்”
ஒரு வேதிவினையில் ஈடுபடும் பொருள்களின் நிலை மற்றும் இயற்பியல் நிலையை ஒரு அடைப்புக்குறிக்குள் சுருக்க குறியீடுகளைப் பயன்படுத்தி குறிப்பிடலாம். எடுத்துக்காட்டாக, திண்ம பொட்டாசியம், நீருடன் வினை புரிந்து பொட்டாசியம் ஹைட்ராக்சைடையும், ஹைட்ரஜன் வாயுவையும் தருகிறது. இவ்வினை சார்ந்த அனைத்து தகவல்களும் கீழ்கண்டவாறு வேதிச்சமன்பாட்டில் குறிக்கப்படுகின்றன.
2K(S) + 2H2O(i) ???? 2KOH(aq) + H2(g)
| குறியீடு | நிலைமை அல்லது இயல்நிலை |
| S | திண்மம் |
| I | நீர்மம் |
| g | வாயு |
| Aq | நீர்க்கரைசல் |
சுவற்றில் வெள்ளையடிக்க நீற்றுச் சுண்ணாம்பு கரைசலைப் பயன்படுத்துகிறோம். கால்சியம் ஹைட்ராக்சைடு, காற்றில் இருக்கும் கார்பன்-டை-ஆக்சைடுடன் வினை புரிந்து கால்சியம் கார்பனேட் உருவாகி மெல்லிய படலமாக சுவர்களில் படிகிறது. வெள்ளையடித்த இரண்டு அல்லது மூன்று தினங்களில் கால்சியம் கார்பனேட் சுவர்களுக்கு ஒரு மினுமினுப்புத் தன்மையைத் தருகிறது. சுண்ணாம்புக்கல்லின் (மார்பிள்) வேதி வாய்ப்பாடு CaCO3
Ca(OH)2(aq) + CO2(g) ???? CaCO3(S) + H2O(I)
நீற்றுச் கார்பன்-டை கால்சியம் நீர்
சுண்ணாம்பு -ஆக்சைடு கார்பனேட்
காயங்களின் ஹைட்ரஜன் பெராக்சைடை ஊற்றும் போது H2O2 என்பது நீராகவும், ஆக்சிஜனாகவும் சிதைவடைகிறது. உருவான ஆக்சிஜன் குமிழ்கள் வெளியேறி விடுவதால் மீன்டும் H2O2 உருவாகுதல் தடுக்கப்படுகிறது.