கார்பனும் அதன் சேர்மங்களும் Notes 10th Science Lesson 11 Notes in Tamil
கார்பனும் அதன் சேர்மங்களும் Notes 10th Science Lesson 11 Notes in Tamil
அறிமுகம்:
நமது அன்றாட வாழ்வில் ஏராளமான கார்பன் சேர்மங்களைப் பயன்படுத்தி வருகிறோம். கார்பன் இல்லாத மனித வாழ்க்கையை நினைத்துக் கூட பார்க்க முடியாது. நாம் உண்ணும் உணவுகள், உடல் நலக்குறைவு ஏற்படும் போது எடுத்துக் கொள்ளும் மருந்துகள், உடுத்தும் உடைகள், வீடு மற்றும் வாகனங்களில் பயன்படுத்தும் எரி பொருட்கள் என நம்மைச் சுற்றியுள்ள அனைத்துப் பொருட்களிலும் கார்பன் அல்லது கார்பனின் சேர்மங்கள் இருக்கிறது. தனிம வரிசை அட்டவணையில் உள்ள அனைத்து தனிமங்களை விடவும் இயற்கையாக மற்றும் மனிதனால் உருவாக்கப்பட்ட கார்பன் சேர்மங்களின் எண்ணிக்கை அதிகமாக இருக்கின்றன. ஐந்து மில்லியனுக்கும் அதிகமான கார்பன் சேர்மங்கள் பூமியில் காணப்படுகின்றன. சங்கிலி தொடாக்கும் தன்மை (Catenation), நான்கு இணை திறன் அமைப்பு, பிற தனிமங்களுடன் சேர்ந்து அதிக அளவில் சேர்மங்களை உருவாக்கும் தன்மை போன்ற கார்பனின் சிறப்பு பண்புகள் மற்ற தனிமங்களிலிருந்து கார்பனை வேறுபடுத்துகின்றன. இதனால் ஹைட்ரஜன், ஆக்சிஜன், நைட்ரஜன், சல்பர் போன்ற அனைத்து தனிமங்களுடனும் எளிதாக பிணைப்பை ஏற்படுத்தி சேர்மங்களை உருவாக்குகிறது. இச்சேர்மங்களை பெரும்பாலும் சகப் பிணைப்பினால் தான் உருவாகின்றன. இச்சேர்மங்களை கரிமச்சேர்மங்கள் என்று அழைக்கலாம். கார்பன் மற்றும் அதன் சேர்மங்களைப் பற்றி இந்த பாடத்தில் நாம் அறிந்து கொள்ள இருக்கிறோம்.
கரிமச்சேர்மங்களின் பொதுப் பண்புகள்:
இந்த உலகில் உள்ள ஒவ்வொரு பொருளுக்கும் சில தனித்துவமான பண்புகள் இருப்பது போல கரிமச் சேர்மங்களுக்கும் சில பொதுப் பண்புகள் இருக்கின்றன. அவைகளில் சில கீழே கொடுக்கப்பட்டுள்ளன.
- கரிமச் சேர்மங்கள் சிக்கலான அமைப்பையும், அதிக மூலக்கூறு நிறையையும் கொண்டுள்ளன.
- கரிமச் சேர்மங்கள் பொதுவாக நீரில் கரையாது. ஆனால் ஈதர், கார்பன் டெட்ராகுளோரைடு, டொலுவின் போன்ற கரிமக் கரைப்பான்களில் கரையும்.
- கரிமச் சேர்மங்கள் எளிதில் எரியக் கூடிய தன்மை உடையவை.
- கரிமச் சேர்மங்களை கனிமச் சேர்மங்களோடு ஒப்பிடுகையில் குறைவாகவே வினை புரிகின்றன. இதனால் அவற்றின் வினை வேகமும் குறைவாகவே இருக்கிறது.
- பெரும்பாலான கரிமச் சேர்மங்கள் இயற்கையாகவே சகப் பிணைப்பைக் கொண்டுள்ளன.
- கரிமச் சேர்மங்கள் கனிமச சேர்மங்களைவிட குறைவான உருகுநிலையும் கொதிநிலையையும் கொண்டுள்ளன.
- கரிமச் சேர்மங்கள் மாற்றியப்பண்பை பெற்றுள்ளன. அதாவது ஒரே மூலக்கூறு வாய்ப்பாட்டை பெற்றுள் கரிமச் சேர்மங்கள் அதனுடைய இயற்பியல் மற்றும் வேதியியல் பண்புகளில் மாறுகின்றன.
- இவை எளிதில் ஆவியாகும் தன்மையுடையது.
- பல்வேறு கரிமச் சேர்மங்களை ஆய்வகத்தில் தயாரிக்கலாம்.
கரிமச் சேர்மங்களை அவற்றின் கார்பன் சங்கிலி வடிவமைப்பைப் பொறுத்து வகைப்படுத்துதல்:
வகைப்படுத்தலின் முக்கியத்துவம் என்ன? இந்த உலகில் லட்சக்கணக்கான கார்பன் சேர்மங்கள் கண்டுபிடிக்கப்பட்டுள்ளன. ஆண்டுதோறும் பல புதிய சேர்மங்கள் கண்டுபிடிக்கப்பட்டு வருகின்றன. கரிமச் சேர்மங்கள் அதிக அளவில் காணப்படுவதாலும் தொடர்ந்து பல கரிமச் சேர்மங்கள் தயாரிக்கப்படுவதாலும் அவைகளை வகைப்படுத்துதல் தேவையானதாகிறது. எனவே ஒவ்வொரு சேர்மத்திற்கும் தனியான மூலக்கூறு அமைப்பை வழங்கி, முறையான வகைப்படுத்துதல் மூலம் வரிசைப்படுத்தி, அமைப்பின் அடிப்படையில் அவற்றிற்கு பெயரிடலாம். ஆரம்ப காலங்களில், ஒரே விதமான மூலக்கூறு அமைப்பினை உடைய சேர்மங்கள், ஒரே மாதிரியான வேதியியல் பண்புகளை பெற்றிருக்கும் என்று அறிவியலாளர்கள் கருதினர். ஆகவே, அவர்கள் ஒரே மாதிரியான மூலக்கூறு அமைப்பினை பெற்றுள்ள சேர்மங்களை வகைப்படுத்த தொடங்கினர். சங்கிலித் தொடராக்கத்தினலான கார்பன் சேர்மங்களை வைத்து கட்டமைக்கப்பட்டது தான் கரிம வேதியியல். கரிமச் சேர்மங்களில், கார்பன் அணுக்கள் மற்ற அணுக்களோடு சகப்பிணைப்பு மூலம் பிணைக்கப்பட்டிருக்கும். இந்த சகப்பிணைப்பு ஒரு சங்கிலித் தொடரை உருவாக்கும். இதனடிப்படையில் கரிமச் சேர்மங்களை இரு வகைகளாகப் பிரிக்கலாம்.
- வளையமற்ற அல்லது திறந்த அமைப்புடைய சேர்மங்கள்:
இவற்றில் கார்பனும் ஹைட்ரஜனும் நேர்க் கோட்டு அமைப்பில் சங்கிலித் தொடரில் இணைகின்றன. அனைத்து கார்பன் அணுக்களும் ஒற்றைப் பிணைப்பில் அமைந்திருந்தால், அது நிறைவுற்ற சேர்மம் என்று அழைக்கப்படுகிறது. ஒன்று அல்லது அதற்கு மேற்பட்ட இரட்டை பிணைப்பு அல்லது முப்பிணைப்பு அமைந்திருந்தால் அது நிறைவுறா சேர்மம் என்ற அழைக்கப்படுகிறது.
CH3 –CH2 –CH3 CH3 –CH = CH2
புரப்பேன் புரப்பீன்
நிறைவுற்ற சேர்மம் நிறைவுறா சேர்மம்
- வளையச் சேர்மங்கள்:
கரிமச் சேர்மங்களின் கார்பன் சங்கிலித் தொடர் மூடியிருந்தால் அவை வளையச் சேர்மங்கள் என்று அழைக்கப்படுகின்றன. ஒரு சங்கிலித் தொடரில் கார்பன் அணுக்கள் மட்டும் அமைந்திருந்தால் அவை கார்போ (ஓரின) வளையச் சேர்மங்கள் என அழைக்கப்படுகின்றன. கார்பன் அணுக்களோடு ஆக்சிஜன், நைட்ரஜன், சல்பர் போன்ற மற்ற சில அணுக்களும் சங்கிலித் தொடரில் இணைந்திருந்தால் அவை பல்லின வளையச் சேர்மங்கள் என அழைக்கப்படுகின்றன. கார்போ வளையச் சேர்மங்களை அலிசைக்கிளிக் சேர்மங்கள் மற்றும் அரோமேட்டிக் சேர்மங்கள் என இரண்டாகப் பிரிக்கலாம். அலிசைக்கிளிக் சேர்மங்கள் நிறைவுற்ற அல்லது நிறைவுறாத, ஒன்று அல்லது அதற்கு மேற்பட்ட கார்போ வளையங்களைப் பெற்றிருக்கும். அரோமேட்டிக் சேர்மங்கள் ஒன்று அல்லது ஒன்றுக்கு மேற்பட்ட பென்சீன் வளையங்களை பெற்றிருக்கும். (வளையத்தில் இரண்டு கார்பன் அணுக்களுக்கு இடையில் ஒன்றுவிட்ட இரட்டைப் பிணைப்பு இருக்கும்.)
கார்பன் அணுக்களின் அமைப்பு மற்றும் கரிமச் சேர்மங்களில் அவற்றின் பிணைப்பு ஆகியவற்றின் அடிப்படையில், கரிமச் சேர்மங்களை வகைப்படுத்துவதை படம் விளக்குகிறது.

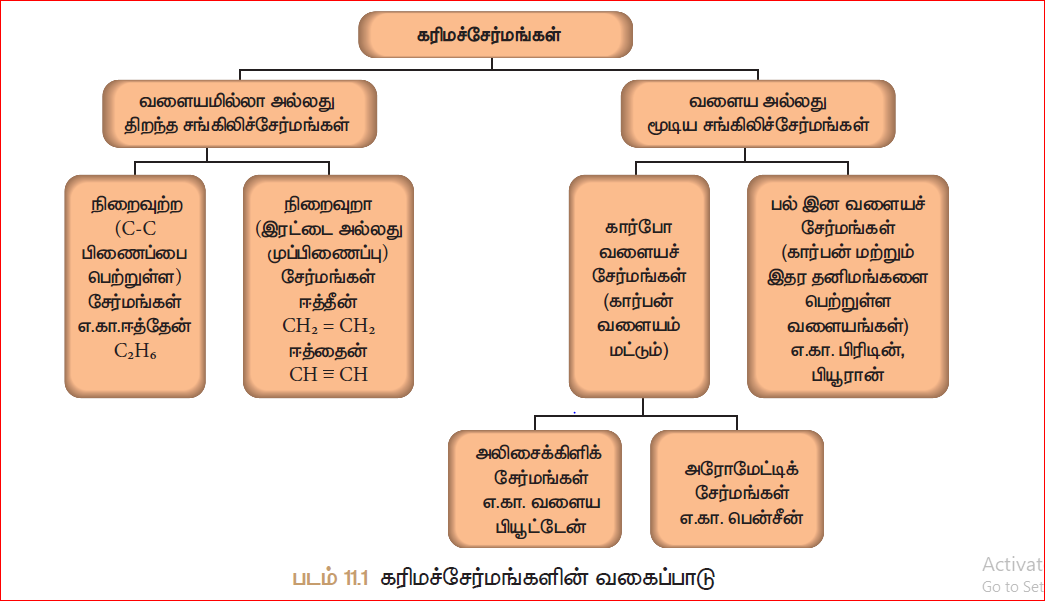
அணுக்களைப் பொறுத்து கரிம சேர்மங்களின் வகைகள்:
கரிமச் சேர்மங்களில் கார்பனைத் தவிர ஹைட்ரஜன், ஆக்சிஜன், நைட்ரஜன் போன்ற அணுக்களும் கார்பனுடன் பிணைப்பை ஏற்படுத்தியிருக்கும். இதனைப் பொறுத்தும் நாம் கரிமச் சேர்மங்களை வகைப்படுத்தலாம். அதில் சில வகைகளை இங்கு காண்போம்.
ஹைட்ரோகார்பன்கள்:
கார்பன் மற்றும் ஹைட்ரஜன் மட்டுமே இணைந்து உருவாகும் சேர்மங்கள் ஹைட்ரோ கார்பன்கள் ஆகும். கார்பன் அணுக்கள் இணைந்து சேர்மத்தின் கட்டமைப்பை உருவாக்குகின்றன. ஹைட்ரோகார்பன் தவிர மற்ற கரிமச் சேர்மங்கள் யாவும் ஒன்று அல்லது அதற்கு மேற்பட்ட ஹைட்ரஜன் அணுக்களுக்கு பதிலாக மற்ற அணுக்களையோ அல்லது அணுக்களின் தொகுதிகளையோ பதிலீடு செய்யப்படுவதன் மூலம் பெறப்படுவதால் ஹைட்ரோ கார்பன்கள் தாய்வழி கரிமச்சேர்மங்களாக கருதப்படுகின்றன. ஹைட்ரோகார்பன்கள் மேலும் மூன்று வகைகளாக பிரிக்கப்படுகின்றன.
அ. அல்கேன்கள்:
CnH2n+2 என்ற பொது வாய்ப்பட்டினைக் கொண்டு (n = 1,2,3,….) கார்பன்களுக்கிடையே ஒற்றைப் பிணைப்பினை பெற்றுள்ள சேர்மங்கள் அல்கேன்கள் ஆகும். N = 1 என எடுத்துக்கொள்ளும் போது அதன் முதல் உறுப்பான மீத்தேன் (CH4) கிடைக்கிறது.
ஆ. அல்கீன்கள்:
CnH2n என்ற பொது வாய்ப்பாட்டினைக் கொண்டு கார்பன்களுக்கிடையே இரட்டைப் பிணைப்பினை பெற்றுள்ள சேர்மங்கள் அல்கீன்கள் ஆகும். N = 2 என எடுத்துக் கொள்ளும் போது அதன் முதல் உறுப்பான எத்திலீன் C2H4 கிடைக்கிறது. இவை நிறைவுறா கரிமச் சேர்மங்கள் ஆகும்.
ஒன்று முதல் ஐந்து கார்பன் பெற்றுள்ள ஹைட்ரோகார்பன்கள்
| கார்பன் அணுக்களின்
எண்ணிக்கை |
அல்கேன்
(CnH2n+2) |
அல்கீன்
(CnH2n) |
அல்கைன்
(CnH2n-2) |
| மீத்தேன் (CH4) | – | – | |
| ஈத்தேன் (C2H6) | ஈத்தீன் (C2H4) | ஈத்தைன் (C2H2) | |
| புரப்பேன் (C3H8) | புரப்பீன்(C3H6) | புரப்பைன் (C3H4) | |
| பியூட்டேன் (C4H10) | பியூட்டீன் (C4H8) | பியூட்டைன்(C4H6) | |
| பென்டேன் (C5H12) | பென்டீன்(C5H10) | பென்டைன் (C5H8) |
இ. அல்கைன்கள்:
CnH2n-2 என்ற பொது வாய்ப்பாட்டினைக் கொண்டு கார்பன்களுக்கிடையே முப்பிணைப்பினை பெற்றுள்ள சேர்மங்கள் அல்கைன்கள் ஆகும். இதன் முதல் உறுப்பு அசிட்டிலின் C2H2 ஆகும். இவையும் நிறைவுறா கரிமச் சேர்மங்கள் ஆகும் மேற்கண்ட மூன்று வகை ஹைட்ரோ கார்பன் சேர்மங்களின் குடும்பத்தில் உள்ள முதல் ஐந்து சேர்மங்கள் அட்டவணையில் அட்டவணைப்படுத்தப்பட்டுள்ளது.
ஹைட்ரோ கார்பன்களின் பண்புகள்:
- குறைவான கார்பன் எண்ணிக்கையைக் கொண்டிருக்கும் ஹைட்ரோ கார்பன்கள் அறை வெப்பநிலையில் வாயுக்களாக உள்ளன. (மீத்தேன், ஈத்தேன் ஆகியவை வாயுக்கள்).
- ஹைட்ரோ கார்பன்கள் நிறம் மற்றும் மணம் இல்லாதவைகள்.
- கார்பன் எண்ணிக்கை அதிகரிக்கும் போது ஹைட்ரோகார்பனின் கொதிநிலை அதிகரிக்கும்.
- ஆக்சிஜனுடன் வினைபுரிந்து இவை கார்பன் டை ஆக்சைடு மற்றும் நீரை கொடுக்கின்றன.
- மற்ற ஹைட்ரோ கார்பனுடன் ஒப்பிடும்போது அல்கேன்கள் குறைவான வினை திறன் கொண்டவை.
- அல்கைன்களில் முப்பிணைப்பு காணப்படுவதால் அவை அதிக வினை திறன் கொண்டுள்ளன. அல்கேன்கள் நிறைவுற்ற கரிமச் சேர்மங்கள், அல்கீன்களும் அல்கைன்களும் நிறைவுறா கரிமச் சேர்மங்கள் ஆகும்.
- ஹைட்ரோ கார்பன்கள் நீரில் கரையாது.
நிறைவுற்ற மற்றும் நிறைவுறா சேர்மங்களை கண்டுபிடிப்பதற்கான சோதனை:
- சோதனை குழாயில் சிறிதளவு மாதிரிக் கரைசலை எடுத்துக் கொள்ளவும்.
- புரோமின் நீரின் சில சொட்டுகளை சோதனை குழாய்க்குள் விட்டு கரைசலின் நிறம் மாறுகிறதா என கவனியுங்கள்.
- கரைசலின் நிறம் மாறினால் கொடுக்கப்பட்டுள்ள மாதிரி நிறைவுறா சேர்மம் கரைசலின் நிறம் மாறவில்லையென்றால் கொடுக்கப்பட்டுள்ள மாதிரி நிறைவுற்ற சேர்மம் ஆகும்.

நிறைவுறா சேர்மங்களை கண்டறிவதற்கான சோதனை.
வினைச் செயல் தொகுதியின் அடிப்படையில் கரிமச் சேர்மங்களின் வகைப்பாடு:
குறைவான வினை திறன் கொண்ட கார்பன், ஹைட்ரஜன் அணுக்களை பயன்படுத்தியே கரிமச் சேர்மங்களின் கட்டமைப்பு அமைந்துள்ளது. ஆனால் இத்தகைய கரிமச் சேர்மங்களுடன் மேலும் சில அணுக்களை சேர்த்தால் பிற சேர்மங்களுடன் வினைபுரியும் தன்மை அதிகரிக்கும். இது சேர்மங்களின் வேதியியல் பண்புகளிலும் பிரதிபலிக்கும். ஓர் சேர்மத்தின் வேதிப் பண்புகளுக்கு
வினைச்செயல் தொகுதியின் அடிப்படையில் கரிமச் சேர்மங்களின் வகைப்பாடு.
| சேர்மம் | வினைச்செயல் தொகுதி | பொதுவான வாய்ப்பாடு | உதாரணம் |
| ஆல்கஹால் | -OH | R-OH | எத்தனால், CH3CH2OH |
| ஆல்டிஹைடு | O
|| -C-H |
R-CHO | அசிட்டால்டிஹைடு, CH3CHO |
| கீட்டோன் | O
|| -C- |
R-CO-R | அசிட்டோன், CH3COCH3 |
| கார்பாக்சிலிக் அமிலம் | O
|| -C-OH |
R-COOH | அசிட்டிக் அமிலம், CH3COOH |
| எஸ்டர் | O
|| -C-OR |
R-COOR | மெத்தில் அசிட்டேட், CH3COOCH3 |
| ஈதர் | -O-R | R-O-R | டைமெத்தில் ஈதர், CH3OCH3 |
காரணமான ஓர் அணு அல்லது அணுக்கள் அடங்கிய தொகுதியே அச்சேர்மத்தின் வினைச் செயல் தொகுதியாகும். ஓரு கரிமச் சேர்மத்தின் வேதி பண்புகள் அனைத்தும் அதன் வினைச் செயல் தொகுதியால் உறுதிப்படுத்தப்படுகின்றன. ஆனால் அச்சேர்மத்தின் இயற்பியல் பண்புகள் மூலக்கூறின் எஞ்சிய பகுதியால் உறுதிப்படுத்தப்படுகின்றன. கார்பன்களுக்கிடையே இருக்கும் பிணைப்புக்களின் எண்ணிக்கையும் (C = C, C = C) வேதியியல் பண்பை தீர்மானிக்கும். –OH, -CHO, -COOH, ஆகியவை சில வினைச் செயல் தொகுதிகள் ஆகும். உதாரணமாக ஈத்தேன் என்பது ஒரு ஹைட்ரோகார்பன். இதன் மூலக்கூறு வாய்ப்பாடு C2H6 இதில் இருக்கும் ஒரு ஹைட்ரஜனை எடுத்துவிட்டு ஒரு OH தொகுதியை சேர்க்கும் போது நமக்கு ஆல்கஹால் கிடைக்கிறது. –OH என்ற வினைத் தொகுதியை தவிர மீதமுள்ள அமைப்பை R என எடுத்துக் கொண்டால் ஆல்கஹாலை R – OH என்ற வாய்ப்பாட்டால் குறிப்பிடலாம். ஓரே வினை செயல் தொகுதியை வைத்து உருவாக்கப்படும் கரிமச் சேர்மங்களை ஒரே வகையைச் சார்ந்தவை எனக் கருதலாம். அட்டவணையில் பல்வேறு சேர்மங்களின் கரிமச் சேர்மங்களின் வகைகள் மற்றும் வினைச் செயல் தொகுதிகள் அட்டவணைப்படுத்தப்பட்டுள்ளது.
அட்டவணையில் வினைச் செயல் தொகுதியின் அடிப்படையில் கரிமச் சேர்மங்களின் வகைப்பாடு

படிவரிசைச் சேர்மங்கள்:
படிவரிசை என்பது ஒரே பொதுவான மூலக்கூறு வாய்ப்பாட்டையும் ஒத்த வேதிப் பண்புகளையும் கொண்ட ஒரே தொகுதி அல்லது ஒரே வகையில் உள்ள கரிமச் சேர்மங்களைக் குறிப்பதாகும். படிவரிசையில் அடுத்தடுத்த சேர்மங்கள் CH2 என்ற தொகுதியால் வேறுபடும். அட்டவணையில் கொடுக்கபட்டுள்ள அல்கேன் தொடரில் உள்ள வெவ்வேறு சேர்மங்களை கீழ்கண்ட வகையில் எழுதலாம்.
மீத்தேன் – CH4
ஈத்தேன் – CH3CH3
புரப்பேன் – CH3CH2CH3
பியூட்டேன் – CH3(CH2)2CH3
பென்டேன் – CH3(CH2)3CH3
மேற்கண்ட வரிசையை உற்று நோக்கும் பொழுது ஒவ்வொரு உறுப்புக்களிலும் முந்தைய உறுப்பினை விட ஒரு மெத்திலின் தொகுதி அதிகமாக இருப்பதை உணர்ந்து கொள்ளலாம். எனவே இவை படிவரிசைச் சேர்மங்கள் என்று அழைக்கப்படுகிறது.
படிவரிசை சேர்மங்களின் பண்புகள்:
- ஒரு படி வரிசையில் உள்ள அடுத்தடுத்த சேர்மங்கள் மெத்திலீன் CH2 என்ற பொது வேறுபாட்டிலும் மூலக்கூறுநிறை 14 amu (அணுநிறை அலகிலும்) வேறுபடுகின்றன.
- ஒரு படி வரிசையில் உள்ள அனைத்து சேர்மங்களும் ஒரே வகை தனிமங்களையும், வினைச்செயல் தொகுதிகளையும் பெற்றிருக்கும்.
- ஒரு படிவரிசையிலுள்ள அனைத்து சேர்மங்களையும் ஒரே பொது வாய்ப்பாட்டினால் குறிப்பிட இயலும். எ.கா: அல்கேன்கள் CnH2n+1.
- மூலக்கூறுநிறையின் அதிகரிப்பைப் பொறுத்து சேர்மங்களின் இயற்பண்புகள் ஒழுங்கான முறையில் மாறுகின்றன.
- எல்லாச் சேர்மங்களும் ஒத்த வேதிவினைகளில் ஈடுபடுகின்றன.
- எல்லாச் சேர்மங்களையும் ஒரே முறையில் தயாரிக்க இயலும்.
கரிமச் சேர்மங்களுக்கு பெயரிடுதல்:
பெயரிடுதலின் அவசியம் என்ன?
முந்தைய காலங்களில் கரிமச்சேர்மங்கள் எங்கிருந்து இயற்கையாக பெறப்படுகிறதோ அதன் பெயரையே கரிமச் சேர்மங்களின் பெயராகச் சூட்டினர். உதாரணமாக பார்மிக் அமிலம் சிவப்பு எறும்புகளிலிருந்து வடிகட்டிப் பெறப்பட்டது. எறும்பின் லத்தீன் பெயர் பார்மிக்கா. எனவே பார்மிக் அமிலம் என்ற பெயர் இலத்தீன் மொழியிலிருந்து உருவானது. பின்பு கரிமச் சேர்மங்களை இயற்கையாக கிடைப்பதை தவிர மற்ற முறைகளிலும் தயாரிக்கத் தொடங்கினர். எனவே அறிவியலாளர்கள் கரிமச் சேர்மங்களின் அமைப்பைப் பொறுத்து அதற்கு முறையாகப் பெயரிடும் விதிகைள வகுத்தனர். அடிப்படை மற்றும் பயன் சார்ந்த வேதியியலின் பன்னாட்டுச் சங்கம் (The International Union of Pure and Applied Chemistry (IUPAC)) வேதிச்சேர்மங்களுக்கு பெயரிடுவதற்கு ஒரு பொதுவான முறையைக் கொண்டு வந்தது.
IUPAC பெயரிடுதலின் கூறுகள்:
IUPAC பரிந்துரைகளின் படி ஒரு கரிமச் சேர்மத்தின் பெயரில் மூன்றுப்பகுதிகள் அமைந்திருக்கும். 1.அடிப்படைச் சொல். 2.முன்னொட்டு (துவக்கும் சொல்), 3.பின்னொட்டு (முடியும் சொல்) இந்த மூன்று பகுதிகளையும் கீழ்கண்டவாறு இணைத்து ஒரு IUPAC பெயரை உருவாக்கலாம்.

1. அடிப்படைச் சொல்: இது கார்பனின் கட்டமைப்பை விளக்கும் அடிப்படை அலகு ஆகும். இது சேர்மத்தின் சங்கிலி தொடரில் உள்ள கார்பன் அணுக்களின் எண்ணிக்கையைக் குறிக்கிறது. கார்பன் சங்கிலியில் இருக்கும் கார்பன் எண்ணிக்கையை பொறுத்து கிரேக்க எண் பெயரை பயன்படுத்தி (முதல் நான்கை தவிர) வருவிக்கப்படுகிறது. முதல் 10 ஹைட்ரோ கார்பன்களின் IUPAC பெயர் அட்டவணையில் கொடுக்கப்பட்டுள்ளது.
ஹைட்ரோ கார்பன்களின் அடிப்படைச் சொல்
| கார்பன்
எண்ணிக்கை |
மூல வார்த்தை |
| 1 | மீத்- |
| 2 | ஈத்- |
| 3 | புரப்- |
| 4 | பியூட்- |
| 5 | பென்ட்- |
| 6 | ஹெக்ஸ்- |
| 7 | ஹெப்ட்- |
| 8 | ஆக்ட-; |
| 9 | நான்- |
| 10 | டெக்- |
2. முன்னொட்டு: ஹைட்ரோ கார்பன்களின் தாய்வழிச் சங்கிலித்தொடரில் பிணைக்கப்பட்டுள்ள பதிலி மற்றும் கிளைகளை குறிக்கிறது. ஹைட்ரஜனை தவிர கார்பன் சங்கிலியில் மற்ற அணுக்கள் மற்றும் அணுத்தொகுதிகளுக்கு பதிலிகள் என்று பெயர். அட்டவணையில் கரிமச் சேர்மங்களின் முக்கிய பதிலிகள் மற்றும் அதன் அதன் முன்னொட்டுகள் குறிப்பிடப்பட்டுள்ளது.
IUPAC பெயரிடுதலில் முன்னொட்டு
| பதிலிகள் | முன்னொட்டு |
| -F | புளோரோ |
| -Cl | குளோரோ |
| -Br | புரோமோ |
| -I | ஐயோடோ |
| -NH2 | அமினோ |
| -CH3 | மெத்தில் |
| -CH2CH3 | எத்தில் |
3. பின்னொட்டு: இது கரிமச் சேர்மத்தின் பெயரின் இறுதியில் வருவது. இது இரண்டு பகுதியாகப் பிரிக்கப்படுகிறது. அவை முதன்மை பின்னொட்டு, மற்றும் இரண்டாம் நிலை பின்னொட்டு ஆகும். முதன்மை பின்னொட்டானது மூலச் சொல்லை தொடர்ந்து வரும்.
தாய்வழிச் சங்கிலி தொடரில் உள்ள கார்பன் கார்பன் அணுக்களுக்கிடையே உள்ள பிணைப்பின் தன்மையை குறிக்கிறது. அனைத்து பிணைப்புகளும் ஒற்றை பிணைப்பாயிருந்தால் “யேன்” என்ற பின்னொட்டும், இரட்டை பிணைப்பாயிருந்தால் “ஈன்” என்ற பின்னொட்டு, முப்பிணைப்பாயிருந்தால் “ஐன்” என்ற பின்னொட்டும் பயன்படுத்தப்படுகிறது. இரண்டாம் நிலை பின்னொட்டு கரிமச் சேர்மத்திலுள்ள வினைச்செயல் தொகுதியைக் குறிப்பிடுகிறது.
IUPAC பெயரிடுதலில் பின்னொட்டு
| சேர்மம் | செயல் தொகுதி | பின்னொட்டு |
| ஆல்கஹால் | -OH | ஆல் |
| ஆல்டிஹைடு | -CHO | ஏல் |
| கீட்டோன் | O
|| -C- |
ஓன் |
| கார்பாக்சிலிக் அமிலம் | -COOH | ஆயிக் அமிலம் |
கரிமச் சேர்மங்களைப் பெயரிடுவதற்கான IUPAC விதிகள்:
விதி 1: அடிப்படைச் சொல்லை தேர்ந்தெடுக்கும் விதமாக நீண்ட கார்பன் சங்கிலி தொடரை கண்டறிய வேண்டும்.
விதி 2: பதிலி அல்லது வினைச் செயல் தொகுதி அண்மையில் அமையும் விதமாக தாய் சங்கிலியின் கார்பன் அணுக்களுக்கு எண்ணிட வேண்டும். இதற்கு இட எண்கள் என்று பெயர். வினைச்செயல் தொகுதிக்கு முன்னுரிமை வழங்கப்பட வேண்டும்.
விதி 3: அல்கீன்கள் மற்றும் அல்கைன்களை பொறுத்த வரையில் இரட்டை மற்றும் முப்பிணைப்பின் இடம் கண்டறியப்பட்டு, அந்த இட எண்ணை தொடர்ந்து கோடு மற்றும் முதன்மை நிலை பின்னொட்டை குறிப்பிட வேண்டும். ஒன்றுக்கு மேற்பட்ட பிணைப்புகளானது (இரட்டை அல்லது முப்பிணைப்பு) சிறிய இட எண்ணை பெறுமாறு தாய்ச் சங்கிலியில் கார்பன் அணுக்களுக்கு எண்ணிடல் வேண்டும்.
விதி 4: கரிமச்சேர்மத்தில் வினைச்செயல் தொகுதி இருந்தால் அந்த இடம் கண்டறியப்பட்டு இட எண்ணுக்கு பின்னால் கோடு மற்றும் இரண்டாம் நிலை பின்னொட்டை குறிப்பிட வேண்டும்.
விதி 5: முதன்மை பின்னொட்டு மற்றும் இரண்டாம் நிலை பின்னொட்டு சேர்க்கப்பட்டு பிறகு முதன்மை பின்னொட்டில் இருக்கும் ‘e’ நீக்கப்பட வேண்டும்.
விதி 6: பதிலியின் இடம் கண்டறியப்பட்டு இட எண்ணை தொடர்ந்து கோடு மற்றும் பதிலியை குறிக்கும் முன்னொட்டு குறிப்பிட வேண்டும்.
IUPAC விதிகளை பயன்படுத்தி ஹைட்ரோ கார்பன்களை பெயரிடுதல்:
சில நேரான மற்றும் கிளைத்தொடர் ஹைட்ரோ கார்பன்களுக்கு IUPAC விதிகளை பயன்படுத்தி பெயரிடுதலைப் பார்ப்போம்.
எ.கா: CH3 –CH2 –CH2 –CH2 –CH3
படி1 : இது ஐந்து கார்பன் இருக்கும் சங்கிலி தொடர். எனவே அடிப்படைச் சொல் “பென்ட்” என எடுத்துக்கொள்வோம். (விதி 1).
படி 2 : கார்பன் அணுக்களுக்கு இடையே உள்ள பிணைப்புகள் எல்லாம் ஒற்றை பிணைப்பு உடையதாக இருக்கிறது. எனவே “யேன்” என்ற பின்னொட்டை சேர்க்க வேண்டும். எனவே IUPAC பெயர்
பென்ட் + யேன் = பென்டேன்
எ.கா 2:
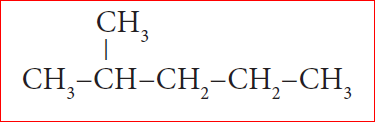
படி 1: நீண்ட சங்கிலித்தொடரில் ஐந்து கார்பன் அணுக்கள் இருக்கின்றன. எனவே மூலவார்த்தை ‘பென்ட்’ என எடுத்துக்கொள்வோம்.
படி 2: இங்கு பதிலிகள் இருக்கின்றன. எனவே கார்பன் சங்கிலியில் பதிலிகள் மிக அண்மையில் அமையும் விதமாக இடது பக்கத்திலிருந்து எண்ணிடுதலை தொடங்க வேண்டும் (விதி 2).
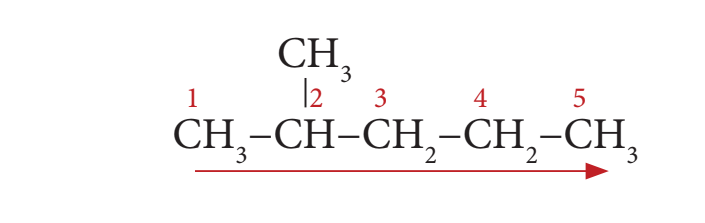
படி 3: எல்லா கார்பன் அணுக்களும் ஒற்றை பிணைப்புயைதாய் இருப்பதால் “யேன்” என்ற பின்னொட்டை சேர்க்க வேண்டும்.
படி 4: பதிலியாக இருக்கும் மெத்தில் தொகுதி இரண்டாவது கார்பன் அணுவுடன் இணைந்துள்ளதால் அதற்குரிய இட எண்ணை கொடுக்க வேண்டும். இங்கு இட எண் 2 எனவே முன்னொட்டு 2 மெத்தில் ஆகும். (விதி 6)
2 மெத்தில் + பென்ட் + யேன் = 2 – மெத்தில் பென்டேன்
எ.கா:3
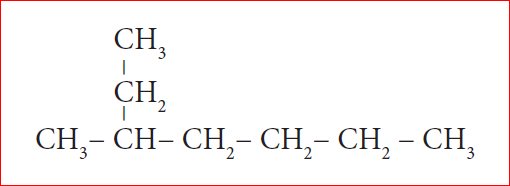
படி 1: நீளமான கார்பன் சங்கிலித் தொடரில் ஏழு கார்பன் அணுக்கள் இருக்கின்றன. எனவே அடிப்படைச் சொல் “ஹெப்ட்” என எடுத்துக்கொள்வோம்.
படி 2: இங்கு ஒரு பதிலி இருக்கிறது. எனவே கார்பன் கார்பன் சங்கிலியில் பதிலிகள் அண்மையில் அமையும் விதமாக எண்ணிடுதலை தொடங்க வேண்டும். (விதி 2)
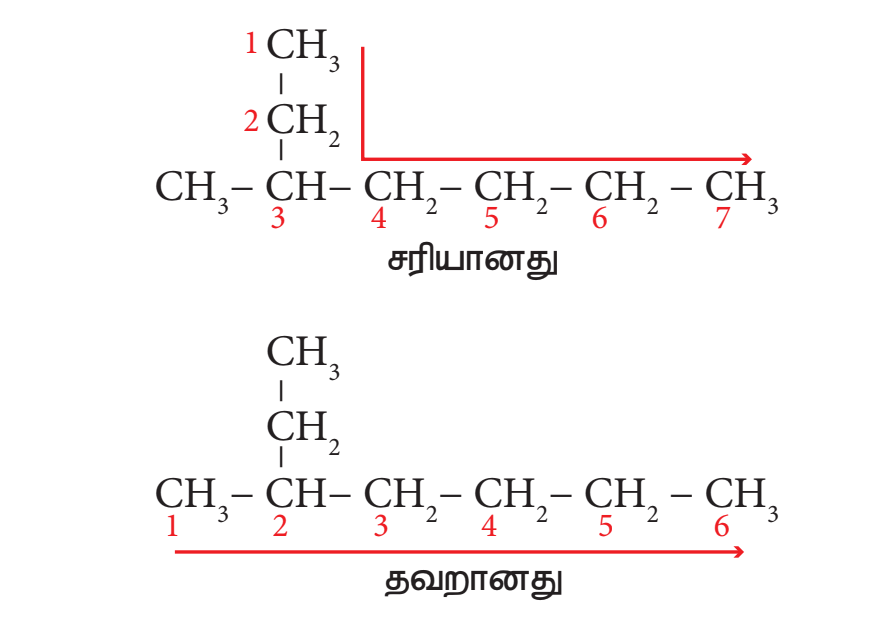
படி 3: எல்லா கார்பன் அணுக்களும் ஒற்றை பிணைப்பு உடையதாக இருப்பதால் “யேன்” என்ற பிணைப்பு சேர்க்க வேண்டும்.
படி 4: பதிலியாக இருக்கும் மெத்தில் தொகுதி மூன்றாவது கார்பன் அணுவுடன் இணைந்து உள்ளது. எனவே இட எண் 3. எனவே முன்னொட்டு 3 – மெத்தில் எனவே சேர்மத்தின் பெயர் 3 – மெத்தில் + ஹெப்ட் + யேன் = 3 – மெத்தில் ஹெப்டேன்.
எ.கா: CH3 –CH2 –CH2 –CH = CH2
படி 1: இது ஐந்து கார்பன் இருக்கும் சங்கிலி தொடர். எனவே அடிப்படைச் சொல் “பென்ட்” என எடுத்துக்கொள்வோம் (விதி 1).
படி 2: கார்பனுகளுக்கிடையே இரட்டை பிணைப்புகள் இருப்பதால் “ஈன்” என்ற பின்னொட்டை சேர்க்க வேண்டும்.
படி 3: இரட்டை பிணைப்பு இருக்கும் கார்பன் அணுவிற்கு சிறிய எண் கிடைக்கும் வகையில் எண்ணிடுதலை ஆரம்பிக் வேண்டும் (விதி 3).
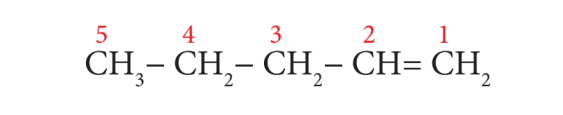
பல்வேறு கரிமச்சேர்மங்களின் IUPAC பெயர்
| கார்பன் அணுக்களின் எண்ணிக்கை | IUPAC பெயர் | |||
| ஆல்கஹால் | ஆல்டிஹைடு | கீட்டோன் | கார்பாக்சிலிக் அமிலம் | |
| 1 | மெத்தனால் (CH3OH) | மெத்தனேல் (HCHO) | – | மெத்தனாயிக் அமிலம் (HCOOH) |
| 2 | எத்தனால் (CH3CH2OH) | எத்தனேல் (CH3CHO) | – | எத்தனாயிக் அமிலம் (CH3COOH) |
| 3 | புரப்பனால் (CH3CH2CH2OH) | புரப்பனேல் (CH3CH2CHO) | புரப்பனோன் (CH3COCH3) | புரப்பனாயிக் அமிலம் (CH3CH2COOH) |
| 4 | பியூட்டனால் (CH3CH2CH2CH2OH) | பியூட்டனேல் (CH3CH2CH2CHO) | பியூட்டனோன் (CH3COCH2CH3) | பியூட்டனாயிக் அமிலம் (CH3CH2CH2COOH) |
| 5 | பென்டனால் (CH3CH2CH2CH2CH2OH) | பென்டனேல் (CH3CH2CH2CH2CHO) | பென்டனோன் (CH3COCH2CH2CH3) | பென்டனாயிக் அமலம் (CH3CH2CH2CH2COOH) |
படி 4: இரட்டை பிணைப்பில் இருக்கும் கார்பன் அணுவின் இட எண் 1. எனவே பின்னொட்டு 1 – ஈன் ஆகும். சேர்மத்தின் பெயர்
பென்ட் + (1 – ஈன்) = பென்ட் – 1 – ஈன் என எழுதலாம்.
பிற வினைச் செயல் தொகுதி கரிமச் சேர்மங்களை பெயரிடுதல்:
எ.கா 1: CH3 –CH2 –CH2 –OH
படி 1: இது மூன்று கார்பன் இருக்கும் சங்கிலித்தொடர். எனவே அடிப்படைச் சொல் புரப் ஆகும்.
படி 2: கார்பன்களுக்கு இடையே உள்ள பிணைப்புகள் எல்லாம் ஒற்றை பிணைப்புகளாக இருப்பதால் “யேன்” என்ற முதன்மை பின்னோட்டை சேர்க்க வேண்டும்.
படி 3: கார்பன் சங்கிலியில் – OH தொகுதி இருப்பதால் இது ஒரு ஆல்கஹால். எனவே – OH தொகுதி அண்மையில் அமையும் விதமாக கார்பன் அணுவிலிருந்து எண்ணிடுதலை தொடங்க வேண்டும். (விதி 3).
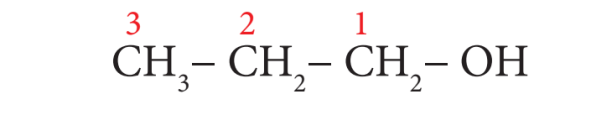
படி 4: OH தொகுதியின் இட எண் 1. எனவே இரண்டாம் நிலை பின்னொட்டாக 1 – ஆல் சேர்க்க வேண்டும். எனவே சேர்மத்தின் பெயர்
புரப் + யேன் + (1 – ஆல்) = புரப்பேன் – 1 – ஆல்
எ.கா 2: CH3COOH
படி 1: இது இரண்டு கார்பன் இருக்கும் சங்கிலி தொடர். எனவே அடிப்படைச் சொல் “எத்” என எடுத்துக்கொள்ளப்படுகிறது.
படி 2: கார்பன்களுக்கு இடையே உள்ள பிணைப்புகள் எல்லாம் ஒற்றை பிணைப்பாய் இருப்பதால் “யேன்” என்ற பின்னொட்டை சேர்க்க வேண்டும்.
படி 3: கார்பன் சங்கிலியின் – COOH தொகுதி இருப்பதால் இது ஒரு கார்பாசிலிக் அமிலம். எனவே இரண்டாம் நிலை பின்னொட்டாக “ஆயிக் அமிலம்”என்ற பின்னொட்டைச் சேர்க்க வேண்டும். எனவே சேர்மத்தின் பெயர்
எத் + யேன் + ஆயிக் அமிலம் = எத்தனாயிக் அமிலம்
அட்டவணையில் பல்வேறு கரிமச் சேர்மங்களுக்குரிய IUPAC பெயர் பட்டியலிடப்படுகிறது.
உன்னைச் சோதித்துப் பார்:
கீழ்கண்ட சேர்மங்களுக்கு IUPAC முறையில் பெயரினை எழுதுக:
(அ) CH3CHO (ஆ) CH3CH2COCH (இ) ClCH2 –CH2-CH2-CH3
எத்தனால் CH3CH2OH:
எத்தனால் பொதுவாக ஆல்கஹால் என்று குறிப்பிடப்படுகிறது. அனைத்து விதமான ஆல்கஹால் பானங்களிலும் சில இருமல் மருந்துகளிலும் எத்தனால் உள்ளது. அதனுடைய மூலக்கூறு வாய்ப்பாடு C2H5OH. அதனுடைய கட்டமைப்பு வாய்ப்பாடு

எத்தனால் தயாரிக்கும் முறை:
தொழிற்சாலைகளில் கரும்புச் சாறின் கழிவுப் பாகிலிருந்து நொதித்தல் முறையில் எத்தனால் தயாரிக்கப்படுகிறது. கழிவுப்பாகு என்பது செறிவு மிகுந்த கரும்புச் சர்க்கரை கரைசலிலிருந்து சர்க்கரையை படிகமாக்கும் பொழுது மீதமுள்ள ஆழ்ந்த நிறமுள்ள கூழ் போன்ற திரவமாகும். இதில் 30% சுக்ரோஸ் உள்ளது. இதை படிகமாக்கல் முறையில் பிரித்தெடுக்க இயலாது. கீழ்க்காணும் படிகள் மூலமாக கழிவுப்பாகு எத்தனாலாக மாற்றப்படுகிறது.
- கழிவுப்பாகினை நீர்த்தல்:
கழிவுப்பாகிலுள்ள சர்க்கரையின் செறிவு 8 லிருந்து 10 சதவீதமாக நீரினால் நீர்க்கப்படுகிறது.
- அம்மோனியம் உப்புகள் சேர்த்தல்:
நொதித்தலின் போது ஈஸ்ட்டிற்க்குத் தேவையான நைட்ரஜன் கலந்த உணவினைக் கழிவுப்பாகு கொண்டுள்ளது. நைட்ரஜன் அளவு குறைவாக இருப்பின், அம்மோனியம் சல்பேட் அல்லது அம்மோனியம் பாஸ்பேட் சேர்ப்பதன் மூலம் உர மூட்டப்படுகிறது.
- ஈஸ்ட் சேர்த்தல்:
படி 2 இல் கிடைக்கும் கரைசல் பெரிய நொதித்தல் தொட்டிகளில் சேகரிக்கப்படுகிறது. பின்னர் ஈஸ்ட் சேர்க்கப்படுகிறது. கலவை 303K வெப்பநிலையில் சில நாட்களுக்கு வைக்கப்படுகிறது. அந்த நாட்களில் ஈஸ்ட்டிலுள்ள இன்வர்டேஸ், மற்றும் சைமேஸ் ஆகிய நொதிகள் சர்க்கரையை எத்தனாலாக மாற்றுகின்றன.
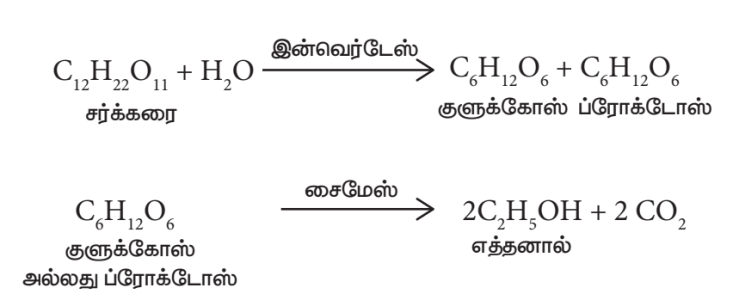
நொதித்த நீர்மம் கழுவு நீர்மம் என அழைக்கப்படுகிறது.
- கழிவு நீர்மத்தைக் காய்ச்சி வடித்தல்:
15 முதல் 18 சதவீதம் ஆல்கஹாலும் மீதிப்பகுதி நீராகவும் உள்ள நொதித்த நீர்மமானது பின்னக் காய்ச்சி வடித்தலுக்கு உட்படுத்தப்படுகிறது. முக்கியப் பின்னப்பகுதியாகக் கிடைத்த எத்தனாலின் நீர்க்கரைசல் 95.5% எத்தனாலையும் 4.5% நீரையும் பெற்றுள்ளது. இது எரிசாரயம் என அழைக்கப்படுகிறது. இக்கலவை சுமார் 5 லிருந்து 6 மணி நேரம் சுட்ட சுண்ணாம்பு சேர்த்து காய்ச்சி வடிக்கப்பட்டு 12 மணி நேரம் வைக்கப்படுகிறது. இக்கலவை மீண்டும் காய்ச்சி வடிக்கப்படும் போது தூய ஆல்கஹால் (100%) கிடைக்கிறது. இந்தத் தூய ஆல்கஹால் தனி ஆல்கஹால் எனப்படுகிறது.
இயற்பியல் பண்புகள்:
- எத்தனால் இனிய மணமுடைய நிறமற்ற, எரி சுவை கொண்ட ஒரு நீர்மம். இது எளிதில் ஆவியாகக் கூடியது.
- இதன் கொதிநிலை 78o C (351K). இது, அதன் ஒத்த அல்கேன்களைக் காட்டிலும் அதிகம். ஈத்தேனின் கொதிநிலை 184K.
- இது நீருடன் எல்லா விகிதத்திலும் முழுவதுமாகக் கலக்கிறது.
வேதிப் பண்புகள்:
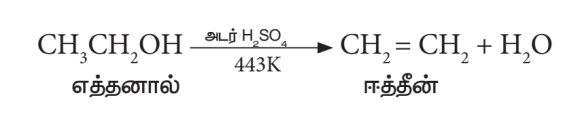
- நீர்நீக்கம்:
எத்தனாலை அதிக அளவு அடர் H2SO4 உடன் 443K க்கு வெப்பப்படுத்தும் போது மூலக்கூறினுள் நீர் நீக்கம் ஏற்பட்டு ஈத்தீனைத் தருகிறது.
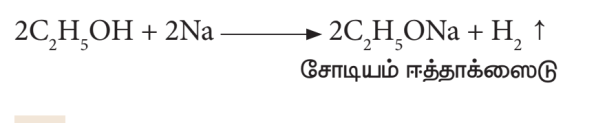
- சோடியத்துடன் வினை:
எத்தனால் சோடியத்துடன் வினைபுரிந்து சோடியம் ஈத்தாக்ஸைடையும், ஹைட்ரஜன் வாயுவையும் தருகிறது.
- ஆக்ஸிஜனேற்றம்:
எத்தனாலைக் காரங்கலந்த KMnO4 அல்லது அமிலங்கலந்த K2Cr2O7 கொண்டு ஆக்ஸிஜனேற்றம் செய்யும் போது எத்தனாயிக் அமிலம் உருவாகிறது.
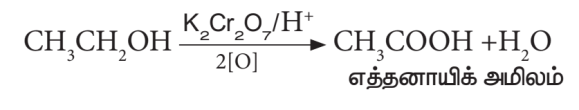
இந்த வினையின் போது ஆரஞ்சு நிறமுடைய K2Cr2O7 பச்சையாக மாறுகிறது. எனவே, இது ஆல்கஹால்களைக் கண்டறியும் சோதனைக்கு பயன்படுகிறது.
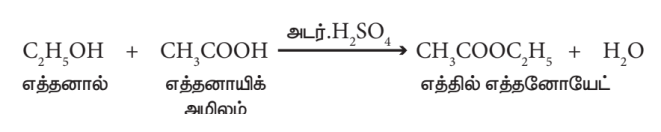
- எஸ்டராக்குதல்:
ஆல்கஹால் கார்பாக்சிலிக் அமிலத்துடன் வினை புரிந்து பழச்சாற்றின் மணமுடைய சேர்மத்தைத் தருகிறது. இச்சேர்மம் எஸ்டர் என்று அழைக்கப்படுகிறது. எத்தனால், எத்தனாயிக் அமிலத்துடன் அடர் H2SO4 முன்னிலையில் எத்தில் எத்தனோயேட் என்ற எஸ்டரைத் தருகிறது. ஆல்கஹால், கார்பாக்ஸிலிக் அமிலத்துடன் வினைபுரிந்து உருவான சேர்மம் எஸ்டர் (பழச்சாறின் மணம் கொண்டது) எனப்படுகிறது. இந்த வினையை எஸ்டராக்குதல் என அழைக்கிறோம்.
- ஹைட்ரஜன் நீக்கம்:
எத்தனாலின் ஆவியை வெப்பப்படுத்தப்பட்ட காப்பர் வினையூக்கியின் முன்னிலையில் (573K) செலுத்தும் போது ஹைட்ரஜன் நீக்கமடைந்து அசிட்டால்ஹைடைத் தருகிறது.
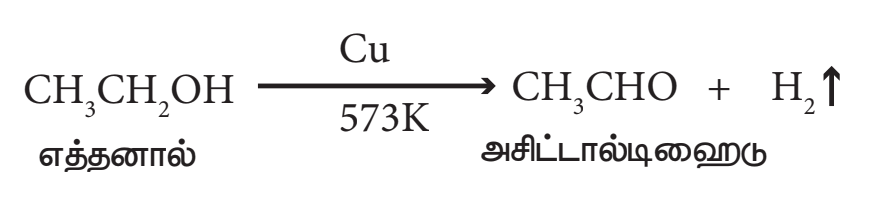
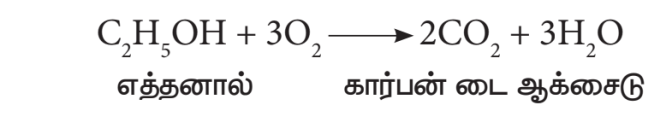
- எரிதல்:
எத்தனால் எளிதில் எரியக்கூடிய திரவம். ஆக்சிஜனுடன் எரிந்து கார்பன் டை ஆக்சைடையும் நீரையும் தருகிறது.
பயன்கள்:
எத்தனால்,
- மருத்துவமனைகளில் காயங்களைத் துடைத்து எடுக்கும் புரைத் தடுப்பானாக பயன்படுகிறது.
- வாகனங்களிலுள்ள குளிர்விப்பானில் தண்ணீர் உறைவதைத்தடுப்பதில் பயன்படுகிறது.
- பூஞ்சைகள் மற்றும் பாக்டீரியா போன்ற நுண்ணுயிரிகளை அழிக்க கைகளைத் தூய்மையாக்கும் கிருமி நாசினிகளில் (Hand sanitizer) பயன்படுத்தப்படுகிறது.
- காயங்களில் கிருமி தொற்று ஏற்படாமல் பாதுகாக்கிறது.
- மருந்துகள், எண்ணெய்கள், கொழுப்புப் பொருள்கள், வாசனைப் பொருள்கள், சாயங்கள் போன்றவற்றைக் கரைக்கும் கரைப்பானாக பயன்படுகிறது.
- மெத்தில் ஆல்கஹால் கலந்த சாராயம் (95% எத்தனால் மற்றும் 5% மெத்தனால்), பெட்ரோல் மற்றும் எத்தனால் கலந்த கலவை (ஆற்றல் ஆல்கஹால்), இயல்புத் தன்மை இழந்த ஆல்கஹால் (எத்தனால் மற்றும் பிரிடின் கலந்தவை) இவை தயாரிப்பதில் பயன்படுகிறது.
- உணவுப்பொருட்களின் சுவையை கூட்டுவதற்கு பயன்படுகிறது. உதாரணமாக வெண்ணிலாச் சாறு (Vennilla essence). இது ஓர் பொதுவான உணவு சுவையூட்டி. இவை ஆல்கஹால், நீர் கலந்த கரைசலில் வெண்ணிலா விதைகள் வினைக்குட்படுத்தப்பட்டு தயாரிக்கப்படுகிறது.
எத்தனாயிக் அமிலம் (CH3COOH):
எத்தனாயிக் அமிலம் அல்லது அசிட்டிக் அமிலம் என்பது கார்பாக்சிலிக் அமில தொகுதியில் முக்கியத்துவமான ஒன்று. இதன் மூலக்கூறு வாய்ப்பாடு C2H4O2 இதன் அமைப்பு வாய்ப்பாடு
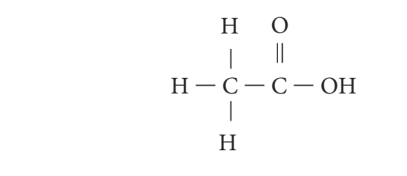
எத்தனாயிக் அமிலம் தயாரித்தல்:
எத்தனாலை காரங்கலந்த பொட்டாசியம் பெர்மாங்கனேட் அல்லது அமிலம் கலந்த பொட்டாசியம்-டை-குரோமேட் கரைசலை கொண்டு ஆக்சிஜனேற்றம் அடையச் செய்து எத்தனாயிக் அமிலத்தை தயாரிக்கலாம்.

இயற்பியல் பண்புகள்:
- எத்தனாயிக் அமிலம் நிறமற்ற, விரும்பதகாத மணமுள்ள ஒரு நீர்மம்.
- இது புளிப்பு சுவையுடையது.
- இது நீருடன் எல்லா விதத்திலும் கலக்கிறது.
- இதன் கொதிநிலை (391K). இதனை ஒத்த ஆல்கஹால், ஆல்டிஹைடுகள், கீட்டோனின் கொதிநிலையை விட அதிகம்.
- குளிர வைக்கும் போது தூய எத்தனாயிக் அமிலம் பனிக்கட்டி போன்ற படிகங்களை உருவாக்குகிறது. எனவே இது (கிளேசியல்) தூய அசிட்டிக் அமிலம் என்று அழைக்கப்படுகிறது.
வேதிப்பண்புகள்:
- உலோகத்துடன் வினை: எத்தனாயிக் அமிலமானது Na, K, Zn முதலிய உலோகங்களுடன் வினைபுரிந்து ஹைட்ரஜன் வாயுவை வெளியிட்டு அதனுடைய எத்தனோயோட்டுகளை தருகிறது.
2 CH3COOH + Zn ???? (CH3COO)2 Zn + H2 ↑
2 CH3 COOH + 2 Na ???? 2 CH3 COONa + H2 ↑
- சோடியம் கார்பனேட்டுடனும், சோடியம் பை கார்பனேட்டுடனும் வினை: எத்தனாயிக் அமிலம், வீரியம் குறைந்த காரமான சோடியம் கார்பனேட்டுடனும், சோடியம் பை கார்பனேட்டுடனும் வினை புரிந்து நுரைத்து பொங்குதல் மூலம் கார்பன் டை ஆக்சைடு வாயுவை வெளியேற்றுகிறது.
2 CH3 COOH + Na2CO3 ???? 2CH3 COONa + CO2 ↑ + H2O
CH3 COOH + NaHCO3 ???? CH3COONa + CO2 ↑ + H2 O
- காரத்துடன் வினை: எத்தனாயிக் அமிலம், சோடியம் ஹைட்ராக்சைடுடன் வினைபுரிந்து சோடியம் எத்தனோயேட்டையும், நீரையும் தருகிறது.
CH3 COOH + NaOH ???? CH3 COONa + H2O
- கார்பாக்ஸில் நீக்கம் (CO2 நீக்கம்): எத்தனாயிக் அமிலத்தின் சோடியம் உப்பைச் சோடா சுண்ணாம்புடன் (3 பகுதி NAOH மற்றும் 1 பகுதி CaO திடக்கலவை) சேர்த்துச் சூடுபடுத்தும் போது மீத்தேன் வாயு உருவாகிறது.
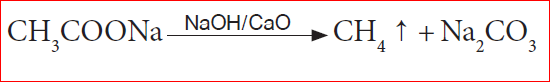
பயன்கள்:
நீர்த்த அசிட்டிக் அமிலமானது (வினிகர்) உணவு சேர்க்கையாகவும், சுவையூட்டியாகவும் மற்றும் உணவு பதப்படுத்தியாகவும் பயன்படுகிறது.
- நெகிழி தயாரிப்பில் பயன்படுகிறது.
- சாயங்கள், நிறங்கள் மற்றும் வண்ணப் பூச்சுகள் தயாரிக்கப்பயன்படுகிறது.
- துணிகளில் அச்சுப் பதிக்க பயன்படுகிறது.
- ஆய்வக கரணியாக பயன்படுகிறது.
- இரப்பர் பாலைக் கெட்டிப்படுத்த பயன்படுகிறது.
- வாசனைப் பொருட்கள் மற்றும் மருந்துகள் தயாரிக்கப் பயன்படுகிறது.
அன்றாட வாழ்வில் கரிமச் சேர்மங்கள்:
மனித வாழ்வையும் கரிமச் சேர்மங்களையும் பிரிக்க இயலாது. பிறப்பு முதல் இறப்பு வரை உள்ள அனைத்து நிலைகளிலும் கரிமச் சேர்மங்கள் மனிதனுக்கு பயன்படுகின்றன. பல வகையான கரிமச் சேர்மங்களையும், அன்றாட வாழ்வில் அவற்றின் பயன்பாட்டையும் நாம் காண்போம்.
ஹைட்ரோ கார்பன்களின் பயன்கள்:
- எரிபொருள் – உதாரணமாக LPG, பெட்ரோல், மண்ணெண்ணெய்.
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொருட்கள்.
- பல படியாக்கல் பொருட்கள், உதாரணமான டயர், நெகிழி புட்டிகள்.
ஆல்கஹால்களின் பயன்கள்:
- கரைப்பான் மற்றும் புரைத்தடுப்பான்.
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொருட்கள்.
ஆல்டிஹைடுகளின் பயன்கள்:
- பார்மால்டி ஹைடு.
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொருட்கள்.
கீட்டோன்களின் பயன்கள்:
- கரைப்பான்.
- கறை நீக்கி.
ஈதர்களின் பயன்கள்:
- மயக்கமூட்டி.
- வலி நிவாரணி.
எஸ்டர்களின் பயன்கள்:
- எல்லா சமையல் எண்ணெய்களிலும் லிப்பிடுகளிலும் எஸ்டர் உள்ளது.
சோப்பு மற்றும் டிடர்ஜெண்ட்:
அழுக்குகளை நீக்கவும் சுத்தப்படுத்துவதற்கும் சோப்பு மற்றும் டிடர்ஜெண்ட்கள் பயன்படுகின்றன. தூய நீரை மட்டும் பயன்படுத்தி துணிகள் மற்றும் உடல்களிலுள்ள அழுக்கு மற்றும் எண்ணெய் பொருட்களை அகற்ற முடியாது. சோப்பு மற்றும் டிடர்ஜெண்ட்களில் இருக்கும் பரப்பு இழுவிசை குறைப்பிகள், நீர் மூலக்கூறுகளை சுற்றி நின்று, பரப்பு இழுவிசையை குறைக்கின்றன. சோப்பு மற்றும் டிடர்ஜெண்ட்கள் வெவ்வேறு வேதியியல் இயல்புகளை கொண்டது. சோப்பு என்பது ஒன்று அல்லது அதற்கு மேற்பட்ட கொழுப்பு அமிலங்களின் உப்பு. இது அழுக்கு நீக்க பயன்படும் ஒரு பொருளாகும். டீடர்ஜெண்ட்களும் அழுக்கு நீக்க பயன்படும் ஒரு வேதிச் சேர்மம் அல்லது வேதி சேர்மங்களின் தொகுப்பு ஆகும். சில குறிப்பிட்ட சூழ்நிலைகளில் இரண்டு சுத்தப்படுத்தும் செயல்களை செய்கிறது. இதனை இந்த பாடத்தில் விரிவாகக் கற்றுக்கொள்வோம்.
சோப்பு:
நீளச்சங்கிலி அமைப்பை உடைய கார்பாக்சிலிக் அமிலங்களின் (கொழுப்பு அமிலங்கள்) சோடியம் அல்லது பொட்டாசியம் உப்புகளே சோப்புக்கள் ஆகும். சோப்பு தயாரிப்பதற்கு இரண்டு மூலப்பொருட்கள் தேவைப்படுகிறது. 1.கொழுப்பு, 2.காரம். பெரும்பாலும் சோப்பு தயாரிக்க சோடியம் ஹைட்ராக்சைடு என்ற காரத்தை பயன்படுத்துகிறார்கள். பொட்டாசியம் ஹைட்ராக்சைடையும் கூட பயன்படுத்தலாம். பொட்டாசியத்தை அடிப்படையாக வைத்து உருவாக்கும் சோப்பானது சோடியத்தை அடிப்படையாக வைத்து உருவாக்கும் சோப்பை விட நீரில் எளிதில் கரைந்து போகும் தயாரிப்புகளை உருவாக்குகிறது. இதன் அடிப்படையில் சோப்பை இரு வகைகளாக பிரிக்கலாம்.
அ. கடின சோப்பு:
எண்ணெய் அல்லது கொழுப்பினை எரி சோடாவுடன் (சோடியம் ஹைட்ராக்சைடு) சோப்பாக்கல் வினைக்கு உட்படுத்தும் போது கடின சோப்பு கிடைக்கிறது. பொதுவாக சலவை செய்வதற்கு இந்த வகை சோப்புகள் பயன்படுத்தப்படுகின்றன.
ஆ. மென் சோப்பு:
எண்ணெய் அல்லது கொழுப்பினை பொட்டாசியம் உப்பினை பயன்படுத்தி சோப்பாக்கல் வினை உட்படுத்தும் போது மென் சோப்பு கிடைக்கிறது. உடலினை சுத்தப்படுத்துவதற்கு இந்த வகை சோப்பினை பயன்படுத்தலாம்.
சோப்பு தயாரிக்கும் முறை:
குடவை முறை:
இது கொஞ்சம் பழமையான முறை. ஆனாலும் சோப்பு தயாரிக்கும் சிறுத் தொழில் நிறுவனங்களில் இந்த முறையே இன்றும் பயன்படுத்தப்படுகிறது. இரண்டு படிநிலைகளை பின்பற்றி இம்முறையில் சோப்பு தயாரிக்கப்படுகிறது.
- சோப்பாக்கல் வினை:
சோப்பு தயாரிக்க பயன்படும் எண்ணெயை ஒரு இரும்புக் குடுவையில் எடுத்து 10% க்கும் சற்று அதிகமான காரக் கரைசலை சேர்க்க வேண்டும். இந்த கலவையின் மீது நீராவியை செலுத்தி கொதிக்க வைக்க வேண்டும். சில மணி நேரங்களுக்குப் பின் எண்ணெய் நீராற் பகுக்கப்படுகிறது. இம்முறைக்கு சோப்பாக்கல் வினை என்று பெயர்.
- உப்பிடுதல்:
கொதித்து கொண்டு இருக்கும் கலவையில் சாதாரண உப்பு சேர்க்கப்படுகிறது. இப்பொழுது தொட்டியின் அடியில் சோப்பு வீழ்படிவாகும். பல மணி நேரங்களுக்கு பின் சோப்பானது திரவத்தின் மேற்பரப்பில் கெட்டியான பொருளாக மிதந்து வரும் இதனை பிரித்தெடுத்து குளிர்விக்கும் போது தேவையான சோப்பு கிடைக்கிறது.
சோப்பு மீது கடின நீரின் விளைவு:
கடின நீரில் இருக்கும் கால்சியம் மற்றும் மெக்னீசியம் அயனிகள் (Ca2+மற்றும் Mg2+) சோப்பின் சுத்தம் செய்யும் செயலை கட்டுப்படுத்துகிறது. கடின நீர் சோப்போடு சேரும்போது ஸ்கம் (உலோக அயனிகளின் வீழ்படிவு) என்ற மெல்லிய படலம் உருவாகிறது. இது உடலிலும், துணியிலும் எளிதில் நீக்க முடியாத ஒருவகை படிவினை உருவாக்குகிறது. காலப்போக்கில் இந்த படிவு துணியின் தரத்தை குறைப்பதோடு சிறிது காலத்தில் துணியானது கிழிந்து போகவும் செய்கிறது. இதனை தவிர்க்க கடின நீரால் பாதிக்கப்படாத வேதிப் பொருட்களை பயன்படுத்தி டிடர்ஜெண்ட்கள் தயாரிக்கப்படுகிறது.
டிடர்ஜெண்ட்கள்:
டிடர்ஜெண்ட்களை தயாரிப்பதன் மூலமாக சலவை துறையில் பல்வேறு மாற்றங்கள் ஏற்பட்டது. இவற்றை கடின நீர் மற்றும் அமிலம் கலந்த நீரில் கூட பயன்படுத்தலாம். சோப்பிலிருக்கும் கார்பாசிலிக் அமில உப்பினைப் போல டிடர்ஜெண்ட்கள் என்பவை சல்போனிக் அமிலம் அல்லது அல்கைல் ஹைட்ரஜன் சல்பேட்டின் உப்புகள் ஆகும். இதனால் டிடர்ஜெண்ட்கள் கடின நீரில் இருக்கும் Ca2+ மற்றும் Mg2+ ஆகியவைகளுடன் சேர்ந்து வீழ்படிவாக்கலை உருவாக்குவதில்லை. எனவே சலவை செய்வதற்கு சோப்பை விட டிடர்ஜெண்ட்களே சிறந்தது.
டிடர்ஜெண்ட்களை தயாரிக்கும் முறை:
பெட்ரோலியத்திலிருந்து கிடைக்கும் ஹைட்ரோ கார்பனோடு சல்பியூரிக் அமிலத்தை சேர்த்து டிடர்ஜெண்ட்கள் தயாரிக்கப்படுகிறது. இந்த வினைகள் மூலம் கிடைக்கும் மூலக்கூறுகள், சோப்பிலுள்ள கொழுப்பு அமில மூலக்கூறுகளை ஒத்து இருக்கிறது. இந்த கலவையுடன் ஒரு காரத்தினை சேர்க்கும் போது பரப்பு இழுவிசை குறைப்பி மூலக்கூறுகளை உருவாக்குகிறது. இவை கடின நீரில் உள்ள தாது உப்புகளுடன் வினை புரியாததால் கடின நீரோடு சேர்ந்து வீழ்படிவை உருவாக்குவதில்லை.
தற்போது உள்ள டிடர்ஜெண்ட்களில் பரப்பு இழுவிசை குறைப்பு மூலக்கூறுகளோடு மேலும் பல பொருட்கள் சேர்க்கப்படுகின்றன. அவைகளில் சில கீழே கொடுக்கப்பட்டுள்ளன.
- சோடியம் சிலிக்கேட்: சலவை இயந்திரங்களில் அரிப்பு ஏற்படாமல் பாதுகாக்க இது சேர்க்கப்படுகிறது.
- ஃப்ளுரெசென்ட் வெண்மை ஏற்றிகள்: துணிகள் பளிச்சிடுவதற்கு இது சேர்க்கப்படுகிறது.
- சோடியம் பெர்போரேட் (ஆக்ஸிஜன் வெளுப்பான்): சலவையின் போது சில வகை கறைகளை நீக்க பயன்படுகிறது.
- சோடியம் சல்பேட்: டிடர்ஜெண்ட் துகள் கெட்டி ஆகாமல் தடுக்க, இது பயன்படுகிறது.
- நொதிகள்: இரத்தம் மற்றும் காய்கறி சாறு போன்ற கறைகளை நீக்க இது சேர்க்கப்படுகிறது.
- சலவை செய்த பின் துணிகளில் நறுமணம் பெறுவதற்காக சில வேதிப் பொருட்கள் சேர்க்கப்படுகின்றன.
சோப்பின் தூய்மையாக்கல் வினை:
ஒரு சோப்பு மூலக்கூறு வேறுபட்ட இரு வேதிப் பகுதிகளை பெற்றுள்ளன. இப்பகுதிகள் நீருடன் வேறுபட்ட முறையில் வினைபுரிகிறது. ஒரு முனை சிறிய தலை போன்ற கார்பாக்சிலேட் தொகுதி கொண்ட முனைவுள்ள பகுதியையும், மறுமுனை பெரிய வால் போன்ற நீளமான ஹைட்ரோ கார்பன் சங்கிலி தொடரையுடைய முனைவற்ற பகுதியையும் பெற்றுள்ளது.
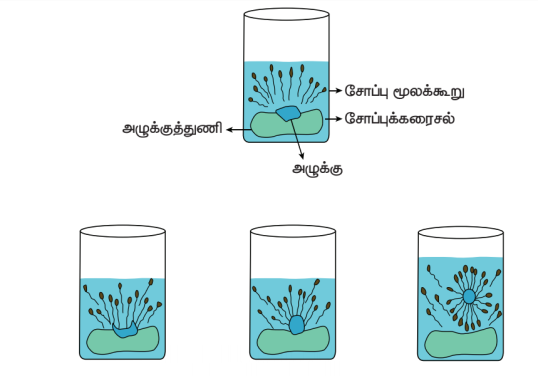
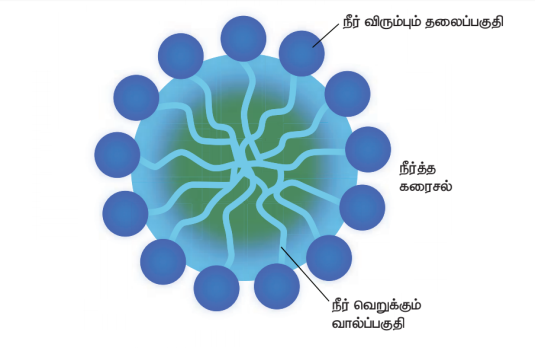
சோப்பு செயல்படும் விதம்
முனைவுள்ள பகுதி நீர் விரும்பும் பகுதியாக செயல்பட்டு நீருடன் ஒட்டிக் கொள்கிறது. முனைவற்ற பகுதி நீரை வெறுக்கும் பகுதியாக செயல்பட்டு ஆடைகளில் உள்ள அழுக்கு மற்றும் எண்ணெய் ஆகியவற்றுடன் ஒட்டிக் கொள்கிறது. நீரை வெறுக்கும் பகுதி மாசினை தன்னுள் அடக்கி கொள்கிறது. நீரை விரும்பும் பகுதி மொத்த மூலக்கூறையும் நீரில் கரைய செய்கிறது. சோப் அல்லது டிடர்ஜெண்டை நீரில் கரைக்கும் பொழுது சோப்பு மூலக்கூறுகள் ஒன்றாக இணைந்த கொத்துகளாக (Micelles) மீசெல்ஸ் உருவாகிறது. இந்த கொத்துகளில் ஹைட்ரோகார்பன் சங்கிலி பகுதியானது, அழுக்கு மற்றும் எண்ணெய் பகுதியோடு ஒட்டிக்கொள்கிறது. இவ்வாறாக சோப்பின் முனைவற்ற பகுதி அழுக்கைச் சுற்றிக் கொள்கிறது. சோப்பின் கார்பாக்ஸிலேட் பகுதி, கொத்துகளை நீரில் கரையச் செய்கிறது. இவ்வாறாக அழுக்கு சோப்பினால் நீக்கப்படுகிறது.
டிடர்ஜெண்ட்களின் பயன்கள்:
சோப்பை விட டிடர்ஜெண்ட்களை பயன்படுத்துவது அதிக நன்மைகளை தருகிறது. ஏனென்றால்,
- டிடர்ஜெண்ட்டை கடின நீர் மற்றும் மென்மையான நீர் இரண்டிலும் பயன்படுத்தலாம். கடின நீரில் சோப்பை விட டிடர்ஜெண்ட்கள் சிறப்பாக செயல் புரியும்.
- உப்பு நீர் மற்றும் அமிலம் கலந்த நீர் ஆகியவற்றில் கூட டிடர்ஜெண்ட்டை பயன்படுத்தலாம்.
- சலவை செய்யும் கலனிலோ, துணிகளிலோ, எந்த விதமான கறைகளையும், அரிப்புகளையும் டிடர்ஜெண்ட் எற்படுத்தாது.
- குளிர்ந்த நீரில் எளிதாக கரையும், மேலும் கடின நீரிலும் எளிதாக அலசலாம்.
- சோப்பை கொண்டு சலவை செய்ய முடியாத கம்பளி போன்ற ஆடைகளையும் டிடர்ஜெண்ட் கொண்டு சலவை செய்யலாம்.
- நீண்ட ஹைட்ரோ கார்பன் சங்கிலித் தொடரை கொண்டுள்ள டிடர்ஜெண்ட்கள் எளிதில் உயிரிய சிதைவிற்கு உட்படும்.
- வாகனங்களில் பயன்படுத்தப்படும் கிரிஸ் தயாரித்தலில் பால்மமாக்கியாக பயன்படுகிறது.
- செயற்கையாக தயாரிக்கப்படும் துணிகளை பாதுகாக்கவும், வெண்மை தன்மையுடன் பிரகாசிக்கவும் டிடர்ஜெண்ட்கள் பயன்படுத்தபடுகின்றன.
உயிரிய சிதைவு மற்றும் உயிரிய சிதைவற்ற டிடர்ஜெண்ட்கள்:
அ. உயிரிய சிதைவு டிடர்ஜெண்ட்கள்:
இவை நேரான ஹைட்ரோ கார்பன் சங்கிலி தொடரை பெற்றவை. இவற்றை நுண்ணுயிரிகளால் எளிதில் சிதைக்க இயலும்.
ஆ. உயிரிய சிதைவற்ற டிடர்ஜெண்ட்கள்:
இவை மிகுந்த கிளைகளை உடைய ஹைட்ரோகார்பன் சங்கிலி தொடர். இவற்றை நுண்ணுயிரிகளால் எளிதாய் சிதைக்க இயலாது.
டிடர்ஜெண்ட்களின் தீமைகள்:
- சில டிடர்ஜெண்ட்களின் ஹைட்ரோ கார்பன் கிளை சங்கிலி தொடரை பெற்றிருக்கும். தண்ணீரில் இருக்கும் நுண்ணுயிரிகளால் இவற்றை மக்க செய்ய இயலாது. இதனால் நீர் மாசடைந்து விடும்.
- சோப்புகளை ஒப்பிடுகையில் டிடர்ஜெண்ட்களின் விலை அதிகம்.
சோப்பு மற்றும் டிடர்ஜெண்ட் வேறுபாடு
| சோப்பு | டிடர்ஜெண்ட் |
| இது நீண்ட சங்கிலி அமைப்பை பெற்ற கார்பாசிலிக் அமிலங்களின் சோடிய உப்புகள் | இது சல்போனிக் அமிலத்தின் சோடியம் உப்புகள் |
| சோப்பின் அயனி பகுதி COO– Na+ | டிடர்ஜெண்டின் அயனிப்பகுதி SO3–Na+ |
| விலங்குகளிடமிருந்து கிடைக்கும் கொழுப்பு மற்றும் தாவரங்களிடமிருந்து கிடைக்கும் எண்ணெய் ஆகியவற்றிலிருந்து சோப்பு தயாரிக்கப்படுகிறது | பெட்ரோலியத்திலிருந்து கிடைக்கும் ஹைட்ரோ கார்பனிலிருந்து இவை தயாரிக்கப்படுகிறது |
| கடின நீரில் பயன்படுத்த முடியாது | கடின நீரிலும் சிறப்பாக சலவை செய்யலாம் |
| கடின நீரடன் சேரும் போது (ஸ்கம்) படிவுகளை உருவாக்கும் | கடின நீருடன் சேரும்போது (ஸ்கம்) படிவுகளை உருவாக்காது |
| குறைவான அளவில் நுரைகளை உருவாக்கும் | அதிகளவில் நுரைகளை உருவாக்கும் |
| உயிரிய சிதைவு அடையும் தன்மை பெற்றது | உயிரிய சிதைவு அடையும் தன்மை அற்றது |
நினைவில் கொள்க:
- படி வரிசை என்பது ஒரே பொதுவான மூலக்கூறு வாய்ப்பாட்டையும், ஒத்த வேதி பண்புகளையும் கொண்ட கரிம சேர்மங்களை குறிப்பதாகும்.
- IUPAC பெயரானது மூன்று பகுதிகளை கொண்டுள்ளது. அவையாவன, அடிப்படை சொல், முன்னொட்டு மற்றும் பின்னொட்டு.
- ஒரு சேர்மத்தின் வேதிப் பண்புகளுக்கு காரணமான ஒரு அணு அல்லது அணுக்கள் அடங்கிய தொகுதியே அச்சேர்மத்தின் வினை செயல் தொகுதி ஆகும்.
- எத்தனாயிக் அமிலம் பொதுவாக அசிட்டிக் அமிலம் என்று குறிப்பிடப்படுகிறது. இது கார்பாசிலிக் அமிலம் தொகுதியை சார்ந்தது.
- எத்தனால் அல்லது எத்தில் ஆல்கஹால் அல்லது எளிய ஆல்கஹால் என்பது ஆல்கஹால் குடும்பத்தைச் சார்ந்த முக்கியமான உறுப்பாகும்.
- நொதிகளின் மூலமாக சிக்கலான கரிம சேர்மங்களில், மெதுவாக வேதிவினை நிகழ்ந்து எளிய மூலக்கூறுகள் உருவாதலே நொதித்தல் எனப்படும்.
- நீளச்சங்கிலி அமைப்பை உடைய கார்பாக்சிலிக் அமிலங்களின் (கொழுப்பு அமிலங்கள்) சோடியம் அல்லது பொட்டாசியம் உப்புகளே சோப்புக்கள் ஆகும்.
- டிடர்ஜெண்ட் என்பவை சல்போனிக் அமிலத்தின் சோடியம் உப்பு ஆகும். இதில் சோப்பில் உள்ள -COOH தொகுதிக்கு பதிலாக – SO3 H தொகுதி உள்ளது.
உங்களுக்கு தெரியுமா?
- ஈஸ்ட் என்பது பூஞ்சை வகுப்பைச் சார்ந்த ஒரு செல் நுண்ணுயிரி ஆகும். பெரிய சிக்கலான கரிம வினைகளில் பூஞ்சைகளில் உள்ள நொதியானது வினை வேக மாற்றியாக செயல்படுகிறது. நொதிகளின் மூலமாக சிக்கலான கரிமச் சேர்மங்களில் மெதுவாக வேதிவினை நிகழ்ந்து எளிய மூலக்கூறுகள் உருவாவதே நொதித்தல் எனப்படும். எடுத்துக்காட்டு: பால் தயிராக மாறுதல்.
- சாதாரண சோப்பை ஏன் கடின நீரில் பயன்படுத்த இயலாது? சாதாரண சோப்பு கடின நீருடன் பயன்படுத்தப்படும் போது கால்சியம் மற்றும் மெக்னீசியம் அயனிகளை வீழ் படிய செய்கிறது. இது துணிகளின் மேற்பரப்பில் ஸ்கம் படிவை உருவாக்குகிறது. எனவே சோப்பை கடின நீரில் எளிதாக பயன்படுத்த இயலாது.
- ‘TFM’ என்ற குறியீட்டை சோப்பு உறைகளில் பார்த்துள்ளீர்களா?

TFM என்றால் மொத்த கொழுப்பு பொருட்கள் (Total Fatty Matter). இது சோப்பின் தரத்தை குறிக்க கூடிய முக்கிய அம்சமாகும். உயர்ந்த TFM பெற்றுள்ள சோப்புகள் சிறந்த குளியல் சோப்பாக பயன்படுகிறது.