அமிலங்கள், காரங்கள் மற்றும் உப்புகள் Notes 9th Science Lesson 14 Notes in Tamil
அமிலங்கள், காரங்கள் மற்றும் உப்புகள் Notes 9th Science Lesson 14 Notes in Tamil
அறிமுகம்
- நம்மைச் சுற்றியுள்ள இந்த உலகம் அதிகளவு வேதிப்பொருட்களால் ஆனது என்பது நாம் அறிந்தது. மண், காற்று, நீர் மற்றும் வாழ்க்கைக்குத் தேவையான அனைத்துப் பொருள்களும் வேதிப் பொருள்களால் ஆனவை. அவற்றுள் குறிப்பாக அமிலங்கள், காரங்கள் மற்றும் உப்புகள் நம் அன்றாட வாழ்வில் பெரிதும் பயன்படுகின்றன.
- பழச்சாறுகள், தூய்மையாக்கிகள் (சலவைப் பொருட்கள்) மருந்துப்பொருள்கள் யாவும் நம் அன்றாட வாழ்வில் முக்கிய பங்கு வகிக்கின்றன.
- நம் உடலின் வளர்சிதை மாற்றமானது நமது வயிற்றில் சுரக்கும் ஹைட்ரோகுளோரிக் அமிலத்தின் மூலமாகவே நடைபெறுகிறது. அமிலம் என்பது சேர்மம்; நீரில் கரையும்பொழுது ஹைட்ரஜன் அயனிகளைத் (H+) தரவல்லது.
- அதே போல் காரம் என்பதும் சேர்மம்; நீரில் கரையும் பொழுது ஹைட்ராக்சைடு (OH–) அயனிகளைத் தரவல்லது.
- அமிலமும், காரமும் ஒன்றோடொன்று வினைபுரிந்து நடுநிலை வினை விளைபொருளைத் தருகின்றன. அதுவே உப்பு ஆகும். இந்தப் பாடப்பகுதியில் இவைகளைப் பற்றி நாம் விரிவாகக் காண்போம்.
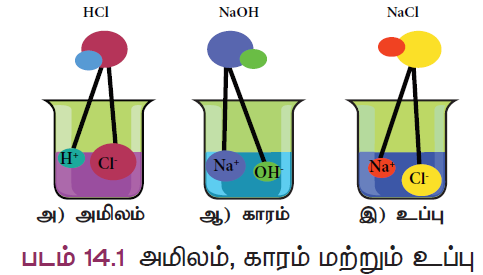
அமிலங்கள்
கீழே கொடுக்கப்பட்டுள்ள நமது அன்றாட வாழ்வில் பயன்படுத்தப்படும் சில பொருட்களின் படத்தைப் பார்க்கவும்.
- சாப்பிடக்கூடிய இந்த அனைத்துப் பொருள்களும் ஒரே சுவையைக் கொண்டவை. அதாவது புளிப்புச் சுவை. இந்த புளிப்புச் சுவையை எது ஏற்படுத்துகிறது? அவற்றில் உள்ள ஏதோ ஒரு வகையான வேதிச் சேர்மங்கள் புளிப்புச் சுவையை ஏற்படுத்துகின்றன. இவைகள் அமிலங்கள் என்றழைக்கப்படுகின்றன.
- ‘ஆசிட்’ என்ற ஆங்கிலச் சொல் ‘அசிடஸ்’ என்ற இலத்தீன் மொழியிலிருந்து பெறப்பட்டது. அதன் பொருள் புளிப்புச் சுவை. புளிப்புச் செவை கொண்ட பொருள்கள் அமிலங்கள் எனப்படும்.
- 1884-ஆம் ஆண்டு ஸ்வீடன் நாட்டு வேதியியலார் ஸ்வான்டே அர்ஹீனியஸ் அமிலங்கள் மற்றும் காரங்களைப் பற்றிய கொள்கையை முன்மொழிந்தார். அர்ஹீனியஸ் கூற்றுப்படி, அமிலங்கள் நீரில் கரையும் பொழுது H+ அயனிகளையோ அல்லது H3O+ அயனிகளையோ தருகின்றன. அமிலங்கள் ஒன்று அல்லது அதற்கு மேற்பட்ட இடப்பெயர்ச்சி செய்யத்தக்க ஹைட்ரஜன் அணுக்களைக் கொண்டவை.
எடுத்துக்காட்டாக ஹைட்ரஜன் குளோரைடு நீரில் கரையும் பொழுது H+ அயனிகளையும் , Cl– அயனிகளையும் தருகிறது.
HCl(aq) H+(aq) + Cl–(aq)
நீரில் அமிலம் மற்றும் காரத்திற்கு என்ன நிகழும்? நீர்த்த கரைசலில் மட்டும்தான் அமிலங்கள் அயனிகளைத் தருகின்றனவா? ஹைட்ரோ குளோரிக் அமிலம் நீருடன் வினைபுரிந்து ஹைட்ரஜன் அயனிகளைத் தருகிறது. நீர் இல்லாத பொழுது ஹைட்ரோகுளோரிக் அமிலத்தில் உள்ள ஹைட்ரஜன் அயனிகளைப் பிரிக்க முடியாது.
HCl + H2O H3O+ + Cl–
ஹைட்ரஜன் அயனிகள் தனித்துக் காணப்படுவது இல்லை. இவை நீருடன் சேர்ந்து ஹைட்ரோனியம் (H3O+) அயனிகளாக உள்ளன. ஆகவே ஹைட்ரஜன் அயனிகள் H+ அல்லது H3O+ ஆக இருக்கும்.
H+ + H2O H3O+
அமிலங்களும் மூலங்களும்
| மூலங்கள் | அமிலங்கள் |
| ஆப்பிள் | மாலிக் அமிலம் |
| எலுமிச்சை | சிட்ரிக் அமிலம் |
| திராட்சை | டார்டாரிக் அமிலம் |
| தக்காளி | ஆக்ஸாலிக் அமிலம் |
| வினிகர் | அசிட்டிக் அமிலம் |
| தயிர் | லாக்டிக் அமிலம் |
| ஆரஞ்சு | அஸ்கார்பிக் அமிலம் |
| தேநீர் | டானிக் அமிலம் |
| வயிற்றில் சுரக்கும் அமிலம் | ஹைட்ரோகுளோரிக் அமிலம் |
| எறும்பு, தேனீயின் கொடுக்கு | பார்மிக் அமிலம் |
பல்வேறு அமிலங்கள் நீரில் கரைந்து எவ்வாறு அயனிகளை உருவாக்குகின்றன என்பதை கீழ்க்கண்ட அட்டவணையில் பார்க்கலாம்.
அமிலங்களால் உருவான அயனிகள்
| அமிலங்கள் | மூலக்கூறு வாய்ப்பாடு | அயனிகள் உருவாதல் | இடப்பெயர்ச்சி செய்யமுடியும் ஹைட்ரஜனின் எண்ணிக்கை | |
| அசிட்டிக் அமிலம் | CH3COOH | H+ | CH3COO– | 1 |
| பார்மிக் அமிலம் | HCOOH | H+ | HCOO– | 1 |
| நைட்ரிக் அமிலம் | HNO3 | H+ | NO3– | 1 |
| சல்பியூரிக் அமிலம் | H2SO4 | H+ | SO42- | 2 |
| பாஸ்பாரிக் அமிலம் | H3PO4 | H+ | PO43- | 3 |
- அனைத்து அமிலங்களும் ஒன்று அல்லது அதற்கு மேற்பட்ட ஹைட்ரஜன் அணுக்களைக் கொண்டவை. ஆனால் ஹைட்ரஜன் உள்ள அனைத்துப் பொருள்களும் அமிலங்கள் அல்ல.
எ.கா. மீத்தேன் (CH4) மற்றும் அம்மோனியா (NH3) ஆகியவை ஹைட்ரஜனைக் கொண்டுள்ளன. ஆனால் இவை நீர்த்த கரைசலில் ஹைட்ரஜன் (H+) அயனிகளைத் தராது.
அமிலங்களின் வகைகள்
அமிலங்கள் கீழ்க்கண்டவாறு பல்வேறு வகைகளில் வகைப்படுத்தப்படுகின்றன.
அ. மூலங்களின் அடிப்படையில்
கரிம அமிலங்கள் : தாவரங்கள் மற்றும் விலங்களில் (உயிரினங்களில்) காணப்படும் அமிலங்கள் கரிம அமிலங்கள் எனப்படும்.
எ.கா: HCOOH, CH3COOH
கனிம அமிலங்கள் : பாறைகள் மற்றும் கனிமப் பொருள்களிலிருந்து பெறப்படும் அமிலங்கள் கனிம அமிலங்கள் எனப்படும்.
எ.கா: HCl, HNO3, H2SO4
ஆ. காரத்துவத்தின் அடிப்படையில்
ஒற்றைக் காரத்துவ அமிலம்:
இவை, ஒரு மூலக்கூறில் ஒரே ஒரு பதிலீடு செய்யப்படக்கூடிய ஹைட்ரஜன் அயனியைப் பெற்ற அமிலங்கள் ஆகும். இது நீர்க்கரைசலில் ஒரு மூலக்கூறு அமிலத்திற்கு ஒரு ஹைட்ரஜன் அயனியைத் தருகிறது.
எ.கா: HCl, HNO3
இரட்டைக் காரத்துவ அமிலம்: இவை நீர்க்கரைசலில் ஒரு மூலக்கூறு அமிலத்திற்கு இரண்டு ஹைட்ரஜன் அயனிகளைத் தருகின்றன.
எ.கா: H2SO4 , H2CO3
மும்மை காரத்துவ அமிலம்: இவை நீர்க்கரைசலில் ஒரு மூலக்கூறு அமிலத்திற்கு மூன்று ஹைட்ரஜன் அயனிகளைத் தருகின்றன.
எ.கா: H3PO4
- அமிலங்களுக்கு காரத்துவம் என்ற பதத்தைப் பயன்படுத்துகிறோம். இது அதிலுள்ள இடப்பெயர்ச்சி செய்யக்கூடிய ஹைட்ரஜன் அணுக்களின் எண்ணிக்கையைக் குறிப்பதாகும். எ.கா. அடிட்டிக் அமிலத்தில் (CH3COOH) நான்கு ஹைட்ரஜன் அணுக்கள் இருந்தாலும், ஒரே ஒரு ஹைட்ரஜனை மட்டுமே இடப்பெயர்ச்சி செய்ய முடியும். எனவே இது ஒற்றைக் காரத்துவமுடையது.
இ. அயனியுறும் அடிப்படையில்
அமிலங்கள் நீரில் முழுவதுமாகவோ அல்லது பகுதியாகவோ கரையும் பொழுது ஹைட்ரஜன் (H+) அயனிகளைத் தருகின்றன. அயனியுறும் ஆற்றல் அடிப்படையில் அமிலங்களை இருவகையாகப் பிரிக்கலாம்.
வலிமை மிகு அமிலங்கள்: இந்த அமிலங்கள் நீரில் முழுவதுமாக அயனியுறுகின்றன. எ.கா: HCl
வலிமை குறைந்த அமிலங்கள்: இந்த அமிலங்கள் நீரில் பகுதியளவே அயனியுறும் தன்மை கொண்டவை. எ.கா: CH3COOH.
- வெப்பம் அல்லது கதிர்வீச்சு அல்லது வேதிவினை அல்லது மின்னிறக்கத்தால் அயனிகளைப் பிரித்தெடுக்கும் நிலை அயனியாதல் எனப்படும்.
ஈ. செறிவின் அடிப்படையில்
செறிவு மிகு அமிலங்கள்: இது ஒரு கரைப்பானில் அதிகளவு கரைந்துள்ள அமிலத்தைக் கொண்டுள்ளது.
நீர்த்த அமிலங்கள்: இது ஒரு கரைப்பானில் குறைந்த அளவு கரைந்துள்ள அமிலத்தைக் கொண்டுள்ளது.
அமிலங்களின் பண்புகள்
அ) அமிலங்கள் புளிப்புச் சுவை உடையவை.
ஆ) இவற்றின் நீர்த்த கரைசல்கள் மின்சாரத்தைக் கடத்தும். ஏனென்றால், இவை அயனிகளைக் கொண்டுள்ளன.
இ) இவை நீல லிட்மஸ்தாளை சிவப்பாக மாற்றும்.
ஈ) அமிலங்கள் செயல்திறன் மிக்க உலோகங்களுடன் வினைபுரிந்து ஹைட்ரஜன் வாயுவைத் தருகின்றன.
Mg + H2SO4 MgSO4 + H2
Zn + 2HCl ZnCl2 + H2
- சில உலோகங்கள் அமிலத்துடன் வினை புரிந்து ஹைட்ரனை வெளியேற்றுவதில்லை. எ.கா: Ag, Cu
உ) அமிலங்கள் உலோக கார்பனேட்டுகள் மற்றும் உலோக பைகார்பனேட்டுகளுடன் வினைபுரிந்து கார்பன் டைஆக்சைடைத் தருகின்றன.
Na2CO3 + 2HCl 2NaCl + H2O + CO2
NaHCO3 + HCl NaCl + H2O + CO2
ஊ) அமிலங்கள் உலோக ஆக்சைடுகளுடன் வினை புரிந்து உப்பையும், நீரையும் தருகின்றன.
CaO + H2SO4 CaSO4 + H2O
எ) அமிலங்கள் காரங்களுடன் வினைபுரிந்து உப்பையும் நீரையும் தருகின்றன.
HCl + NaOH NaCl + H2O
இது நடுநிலையாக்கல் வினை எனப்படும்.
அமிலங்களின் பயன்கள்
- சல்பியூரிக் அமிலம் வேதிப் பொருள்களின் அரசன் என்றழைக்கப்படுகிறது. ஏனெனில் பல சேர்மங்கள் தயாரிப்பதற்கு இது பயன்படுகிறது. வாகன மின்கலங்களிலும் இது பயன்படுகிறது.
- ஹைட்ரோ குளோரிக் அமிலம், கழிவறைகளைத் தூய்மைப்படுத்தும் பொருளாகப் பயன்படுகிறது.
- சிட்ரிக் அமிலம் உணவுப் பொருள்களைப் பதப்படுத்தவும், நுரைத்துப்பொங்கும் உப்புகள் தயாரிக்கவும் பயன்படுகிறது.
- நைட்ரிக் அமிலம் உரமாகப் பயன்படும் அம்மோனியம் நைட்ரேட் என்ற சேர்மத்தையும், சாயங்கள், வண்ணப் பூச்சுகள் மற்றும் மருந்துகளையும் தயாரிக்கப் பயன்படுகிறது.
- ஆக்ஸாலிக் அமிலம் குவார்ட்ஸ் படிகத்தில் ஏற்படும் இரும்பு மற்றும் மாங்கனீசு படிவுகளை சுத்தம் செய்யவும், மரப்பொருள்களைத் தூய்மையாக்கவும் மற்றும் கருப்புக்கறைகளை நீக்கவும் பயன்படுகிறது.
- கார்பானிக் அமிலம் காற்று அடைக்கப்பட்ட பானங்களில் பயன்படுகிறது.
- டார்டாரிக் அமிலமானது ரொட்டிச் சோடாவின் ஒரு பகுதிப்பொருளாகும்.
அமிலக் கரைசலில் நீரின் பங்கு
அமிலங்கள் நீரில் கரையும் போது மட்டுமே தங்களின் பண்புகளை வெளிப்படுத்தும். நீரில் கரையும் போது ஹைட்ரஜன் (H+) அயனிகளைத் தருவதால், அது அமிலம் என அறியமுடிகிறது. அதே சமயம் கரிமக் கரைப்பானில் அமிலங்கள் அயனியுறுவதில்லை.
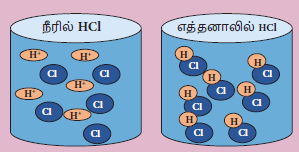
எ.கா: ஹைட்ரஜன் குளோரைடு நீரில் கரையும்போது H+ , Cl – அயனிகளைத் தருகிறது. அதே சமயம் எத்தனால் போன்ற கரிமக் கரைப்பானில் அயனியுறாமல் மூலக்கூறுகளாகவே இருக்கும்.
இராஜதிராவகம்
- உலோகங்களில் தங்கம் மற்றும் வெள்ளி மட்டுமே HCl மற்றும் HNO3 உடன் வினைபுரியாது என்பது நாம் அறிந்த ஒன்று. ஆனால் இந்த இரண்டு அமிலங்களின் கலவை தங்கத்தைக் கரைக்கும் திறனுள்ளது. அந்த கலவையின் பெயர் இராஜதிராவகம் எனப்படும்.
- இராஜதிராவகம் என்பது மூன்று பங்கு ஹைட்ரோகுளோரிக் அமிலம், ஒரு பங்கு நைட்ரிக் அமிலம் கலந்த கலவை ஆகும். இதன் மோலார் விகிதம் 3 : 1. இது மஞ்சள் – ஆரஞ்சு நிறமுடைய புகையக்கூடிய திரவம் ஆகும். இது தங்கம் மற்றும் சில கடின உலோகங்களையும் அதிக அளவில் அரிமானம் செய்யக்கூடிய திறன் கொண்டது.
- இராஜ திராவகம் என்ற சொல் இலத்தீன் மொழியிலிருந்து பெறப்பட்டது. இதன் பொருள் திரவத்தின் அரசன் என்பதாகும். இது மிகுந்த ஆற்றல் கொண்டது. இராஜதிராவகம் மிக உன்னதமான நிலையில் உள்ள தங்கம், பிளாட்டினம் மற்றும் பெல்லேடியம் போன்ற உலோகங்களைக் கூட கரைக்கவல்லது.
வேதி வாய்ப்பாடு : 3HCl + HNO3
நீரில் கரைதிறன் : கரையும்
உருகு நிலை : -420C (-440 F, 231 K)
கொதி நிலை : 1080C (2260 , 381 K)
இராஜதிராவகத்தின் பயன்கள்
- தங்கம் மற்றும் பிளாட்டினம் போன்ற உலோகங்களைக் கரைப்பதற்கு முதன்மையாகப் பயன்படுத்தப்படுகிறது.
- தங்கத்தை சுத்தம் செய்யவும், சுத்திகரிக்கவும் பயன்படுகிறது.
காரங்கள்
அர்ஹீனியஸ் கொள்கையின்படி, காரங்கள் நீரில் கரையும்போது ஹைட்ராக்சைடு (OH–) அயனிகளைத் தருவனவாகும். சில உலோக ஆக்சைடுகள் அமிலங்களுடன் வினைபுரிந்து உப்பையும், நீரையும் தருகின்றன. இவை காரங்கள் என்று அழைக்கப்படுகின்றன. நீரில் கரையும் காரங்கள் எரிகாரங்கள் (Alkali) என்றழைக்கப்படுகின்றன. ஒரு காரம் அமிலத்துடன் வினைபுரிந்து உப்பையும், நீரையும் மட்டும் தரும்.
காரம் + அமிலம் உப்பு + நீர்
எடுத்துக்காட்டாக, ஜிங்க் ஆக்சைடு (ZnO), HCl உடன் வினைபுரிந்து ஜிங்க் குளோரைடு உப்பு மற்றும் நீரைத் தருகிறது.
ZnO(S) + 2HCl(aq) ZnCl2(aq) + H2O(1)
இதேபோல் சோடியம் ஹைட்ராக்சைடு நீரில் அயனியுற்று, ஹைட்ராக்சைடு அயனிகளைத் தருகிறது. ஆகவே, இது நீரில் கரைகிறது. எனவே இது ஒரு எரிகாரம் ஆகும்.
NaOH(aq) Na+(aq) + OH–(aq)
காரங்கள் ஒன்று அல்லது அதற்கு மேற்பட்ட இடப்பெயர்ச்சி செய்யத்தக்க ஆக்சைடு மற்றும் ஹைட்ராக்சைடு அயனிகளைக் கொண்டுள்ளன.
அட்டவணையில் காரங்கள் நீரில் கரைந்து அயனிகளை உருவாக்குவதைக் காட்டுகிறது.
நீரில் காரத்தின் மூலம் உருவான அயனிகள்
| காரம் | மூலக்கூறு வாய்ப்பாடு | அயனிகள் உருவாதல் | இடப்பெயர்ச்சி செய்யத்தக்க ஆக்ஸைடு / ஹைட்ராக்சில் அயனி | |
| கால்சியம் ஆக்சைடு | CaO | Ca2+ | O2- | 1 |
| சோடியம் ஆக்சைடு | Na2O | Na+ | O2- | 1 |
| பொட்டாசியம் ஹைட்ராக்சைடு | KOH | K+ | OH– | 1 |
| கால்சியம் ஹைட்ராக்சைடு | Ca(OH)2 | Ca2+ | OH– | 2 |
| அலுமினியம் ஹைட்ராக்சைடு | Al (OH)3 | Al3+ | OH– | 3 |
- அனைத்து எரிகாரங்களும் காரங்கள் ஆகும். ஆனால் அனைத்துக் காரங்களும் எரிகாரங்கள் அல்ல.
எ.கா: NaOH மற்றும் KOH எரிகாரங்கள் ஆகும். Al(OH)3 மற்றும் Zn (OH)3 காரங்கள் ஆகும்.
காரங்களின் வகைகள்
அ. அமிலத்துவத்தின் அடிப்படையில் காரங்கள்
ஒற்றை அமிலத்துவ காரம்: இவை நீரில் அயனியுற்று ஒரு மூலக்கூறு காரத்திற்கு ஒரு ஹைட்ராக்சைடு அயனியைத் தருபவை. எ.கா: NaOH, KOH
இரட்டை அமிலத்துவக் காரம்: இவை நீரில் அயனியுற்று, ஒரு மூலக்கூறு காரத்திற்கு இரு ஹைட்ராக்சைடு அயனிகளைத் தருபவை.
எ.கா: Ca(OH)2 , Mg(OH)2
மும்மை அமிலத்துவக் காரம் : இவை நீரில் அயனியுற்று, ஒரு மூலக்கூறு காரத்திற்கு மூன்று ஹைட்ராக்சைடு அயனிகளைத் தருபவை.
எ.கா: Al(OH)3 , Fe(OH)3
ஆ. செறிவின் அடிப்படையில் காரங்கள்
செறிவு மிகு காரங்கள்: இவை நீர்க் கரைசலில், அதிக சதவீதம் காரத்தைக் கொண்டுள்ளன.
நீர்த்த காரங்கள்: இவை நீர்க் கரைசலில், குறைந்த சதவீதம் காரத்தைக் கொண்டுள்ளன.
இ. அயனியாதல் அடிப்படையில் காரங்கள்
வலிமை மிகு காரங்கள்: இவை நீர்த்த கரைசலில் முழுவதுமாக அயனியுறுகின்றன.
எ.கா: NaOH, KOH
வலிமை குறைந்த காரங்கள்: இவை நீர்த்த கரைசலில் பகுதியளவே அயனியுறுகின்றன. எ.கா: NH4OH, Ca(OH)2
- அமிலத்துவம் என்பது ஒரு கார மூலக்கூறிலுள்ள இடப்பெயர்ச்சி செய்யக்கூடிய ஹைட்ராக்சில் தொகுதிகளின் எண்ணிக்கையாகும்.
காரங்களின் பண்புகள்
அ) காரங்கள் கசப்புச் சுவை கொண்டவை.
ஆ) நீர்த்த கரைசலில் சோப்பு போன்ற வழவழப்புத் தன்மையைக் கொண்டவை.
இ) சிவப்பு லிட்மஸ் தாளை நீல நிறமாக மாற்றுபவை.
ஈ) இவற்றின் நீர்த்த கரைசல்கள் மின்சாரத்தைக் கடத்தும் திறன் உடையவை.
உ) காரங்கள், உலோகங்களுடன் வினைபுரிந்து உப்பையும், ஹைட்ரஜனையும் தருகின்றன.
Zn + 2NaOH Na2ZnO2 + H2
ஊ) காரங்கள், அலோக ஆக்சைடுகளுடன் வினைபுரிந்து உப்பையும், நீரையும் தருகின்றன. இந்த வினையானது அமிலத்திற்கும், காரத்திற்கும் இடையே உள்ள வினை போல உள்ளதால், அலோக ஆக்சைடுகள் அமிலத் தன்மையுடையது என்ற முடிவுக்கு வரலாம்.
Ca(OH)2 + CO2 CaCO3 + H2O
எ) காரங்கள், அமிலங்களுடன் வினைபுரிந்து உப்பையும், நீரையும் தருகின்றன.
KOH + HCl KCl + H2O
மேலே குறிப்பிட்ட வினை, காரத்திற்கும் அமிலத்திற்கும் இடையே ஏற்படும் நடுநிலையாக்கல் வினை எனப்படும்.
ஏ) அம்மோனியம் உப்புகளுடன், காரங்களை வெப்பப்படுத்தும்போது, அம்மோனியா வாயு உருவாகிறது.
NaOH + NH4Cl NaCl + H2O + NH3
சில உலோகங்கள் சோடியம் ஹைட்ராக்சைடுடன் வினைபுரிவதில்லை. Cu, Ag, Cr.
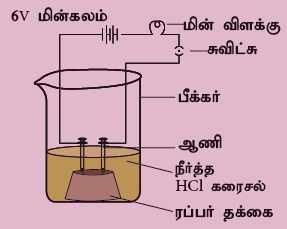
ஹைட்ரோ குளோரிக் அமிலம் (அ) சல்பியூரிக் அமிலத்தை எடுத்துக் கொள்ளவும். ஒரு தக்கையில் இரண்டு ஆணிகளைப் பொருத்தி, அதை 100 மிலி பீக்கரில் வைக்கவும். ஆணிகளை 6V மின்கலத்துடனும், மின் விள்க்குடனும் பொருத்த வேண்டும். இப்பொழுது நீர்த்த ஹைட்ரோ குளோரிக் அமிலத்தை பீக்கரில் ஊற்றி, சுவிட்சை அழுத்தவும். மின் விளக்கு ஒளிர்கிறதா? எப்படி? இதே சோதனையை நீர்த்த சல்பியூரிக் அமிலம், குளுக்கோஸ் மற்றும் ஆல்கஹால் கொண்டு செய்யவும். மேற்கண்ட அனைத்து சோதனைகளிலும் மின்விளக்கு எரிகிறதா? ஏன்?
மேற்கண்ட சோதனைகளில் மின் விளக்கானது, அமிலத்தில் மட்டும் ஒளிரும். ஆனால், குளுக்கோஸ் மற்றும் ஆல்கஹால் மின்சாரத்தைக் கடத்தாது. மின்விளக்கு ஒளிர்வது கரைசலின் வழியே மின்சாரம் பாய்கிறது என்பதை உணர்த்துகிறது. மின்சாரமானது அயனிகளின் மூலமாக கரைசலில் எடுத்துச் செல்லப்படுகிறது. இதே சோதனையை காரங்களான சோடியம் ஹைட்ராக்சைடு மற்றும் கால்சியம் ஹைட்ராக்சைடுடன் செய்து பார்க்கவும்.
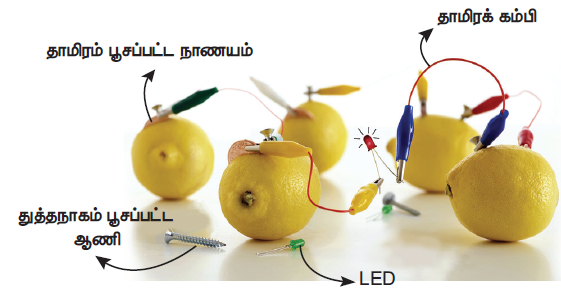
நீங்களாகவே செய்து பார்க்கவும்: படத்தில் காட்டியுள்ளவாறு எலுமிச்சை மின்கலம் அமைக்கவும்.
காரங்களின் பயன்கள்
- சோப்பு தயாரிக்க சோடியம் ஹைட்ராக்சைடு பயன்படுகிறது.
- கட்டிடங்களுக்கு சுண்ணாம்பு பூச கால்சியம் ஹைட்ராக்சைடு பயன்படுகிறது.
- வயிற்றுக் கோளாறுக்கு மருந்தாக மெக்னீசியம் ஹைராக்சைடு பயன்படுகிறது.
- துணிகளில் உள்ள எண்ணெய்க் கறைகளை நீக்குவதற்கு அம்மோனியம் ஹைட்ராக்சைடு பயன்படுகிறது.
அமிலங்கள் மற்றும் காரங்களைக் கண்டறியும் சோதனைகள்
அ) லிட்மஸ் தாளுடன் சோதனை
அமிலம் நீல லிட்மஸ் தாளை சிவப்பாக மாற்றும். காரம் சிவப்பு லிட்மஸ் தாளை நீலமாக மாற்றும்.
ஆ) நிறங்காட்டி பினாப்தலீனுடன் சோதனை
அமிலத்தில் பினாப்தலீன் நிறமற்றது. காரத்தில் இளஞ்சிவப்பு நிறத்தை உருவாக்கும்.

இ) நிறங்காட்டி மெத்தில் ஆரஞ்சுடன் சோதனை
அமிலத்தில் மெத்தில் ஆரஞ்சு இளஞ்சிவப்பு நிறத்தை உருவாக்கும். காரத்தில் மெத்தில் ஆரஞ்சு மஞ்சள் நிறத்தை உருவாக்கும்.

அமில கார நிறங்காட்டி
| நிறங்காட்டி | அமிலத்தில் நிறம் | காரத்தில் நிறம் |
| லிட்மஸ் | நீலம் – சிவப்பு | சிவப்பு – நீலம் |
| பினாப்தலீன் | நிறமற்றது | இளஞ்சிவப்பு |
| மெத்தில் ஆரஞ்சு | இளஞ்சிவப்பு | மஞ்சள் |
அமிலம் மற்றும் காரக் கரைசல்களின் வலிமை
pH அளவீடு
கரைசலை, ஹைட்ரஜன் அயனிகளின் செறிவின் அடிப்படையில் அளவிடுதலே pH அளவீடு எனப்படும். pH –இல் உள்ள p என்பது ஜெர்மன் மொழியில் உள்ள “பொட்டன்ஷ்” என்ற வார்த்தையைக் குறிக்கிறது. இதன் பொருள் “அதிக ஆற்றல்” என்பதாகும். pH அளவீட்டில் 0 முதல் 14 வரை அளவிடப்படும். pH மதிப்புகள், ஒரு கரைசலின் அமிலத்தன்மை, காரத்தன்மை மற்றும் நடுநிலைத் தன்மை ஆகியவற்றை அடையாளம் காண உதவுகின்றன.
- அமிலத் தன்மை கொண்ட கரைசலின் மதிப்பு 7 ஐ விடக் குறைவாக இருக்கும்.
- காரத் தன்மை கொண்ட கரைசலின் மதிப்பு 7ஐ விட அதிகமாக இருக்கும்.
- நடுநிலைத் தன்மை கொண்ட கரைசலின் மதிப்பு 7-க்குச் சமமாக இருக்கும்.
உப்புகள்
உப்பு என்றாலே சாதாரண உப்பு உங்கள் நினைவிற்கு வரலாம். கடல் நீரில் பல வகையான உப்புகள் கரைந்துள்ளன. அவற்றிலிருந்து சோடியம் குளோரைடு பிரித்தெடுக்கப்படுகிறது. இவை பல வகைகளில் பயன்படுகின்றன. அனைத்து உப்புகளும் அயனிகளின் சேர்மமாகும். அமிலங்களுக்கும், காரங்களுக்குமிடையே நிகழும் நடுநிலையாக்கும் வினையின் மூலம் கிடைக்கும் விளை பொருள்களே உப்புகளாகும். இவை நீரில் கரைந்து நேர் மற்றும் எதிர் அயனிகளை உருவாக்குகின்றன.

உப்புகளின் வகைகள்
சாதாரண உப்புகள்:
ஓர் அமிலம் மற்றும் காரம் இவற்றின் முழுமையான நடுநிலையாக்கலின் போது சாதாரண உப்பு கிடைக்கிறது.
NaOH + HCl NaCl + H2O
அமில உப்புகள்:
ஓர் உலோகமானது அமிலத்திலுள்ள ஹைட்ரஜன் அணுக்களின் பகுதியளவை வெளியேற்றுவதால் இவை உருவாகின்றன. பல காரத்துவ அமிலத்தை ஒரு காரத்தினால் பகுதியளவு நடுநிலையாக்கி இவை பெறப்படுகின்றன.
NaOH + H2SO4 NaHSO4 + H2O
கார உப்புகள்:
இவை இரு அமிலத்துவ அல்லது மூன்று அமிலத்துவக் காரங்களிலுள்ள ஹைட்ராக்சைடு அயனிகளை ஓர் அமிலத்தால் பகுதியளவு வெளியேறச் செய்து பெறப்படுகிண்றன.
Pb(OH)2 + HCL Pb(OH)Cl + H2O
இரட்டை உப்புகள்:
சமமான மூலக்கூறு எடைவிகித அளவுகளில் இரண்டு எளிய உப்புகளின் நிறைவுற்ற கரைசல்களைச் சேர்த்து படிகமாக்கும் போது இரட்டை உப்புகள் உருவாகின்றன. உதாரணமாக, பொட்டாஷ் படிகாரம் என்பது பொட்டாசியம் சல்பேட் மற்றும் அலுமினியம் சல்பேட் கலந்த கலவையாகும்.
KAl(SO4)2. 12H2O
உப்புகளின் பண்புகள்
- உப்புகள் பெரும்பாலும் திடப்பொருள்களாகும். அதிக வெப்பநிலையில் உருகவும், கொதிக்கவும் செய்கின்றன.
- பெரும்பாலான உப்புகள் நீரில் கரையும். எ.கா: சோடியம் குளோரைடு, பொட்டாசியம் குளோரைடு, ஆனால் சில்வர் குளோரைடு நீரில் கரையாது.
- நிறமற்றது. வெண்மையானது, கன சதுர படிகம் அல்லது படிகத் தூளாக இருக்கும்.
- நீரை உறிஞ்சும் தன்மையுடையது.
படிக நீர்
பல உப்புகள் நீர் மூலக்கூறுகளுடன் இணைந்து படிகமாகக் காணப்படுகின்றன. இந்த நீர் மூலக்கூறுகள் படிக நீர் எனப்படும். படிக நீரைக் கொண்ட உப்புகள் நீரேற்ற உப்புகள் எனப்படும். உப்புடன் இணைந்து நீரேற்றம் கொண்ட நீர் மூலக்கூறுகளை வேதி வாய்ப்பாட்டிற்குப் பின் ஒரு புள்ளி வைத்து அதன் அளவு குறிப்பிடப்படும். எ.கா காப்பர் சல்பேட் என்ற உப்பில் ஐந்து நீர் மூலக்கூறுகள் உள்ளன. அதனை இவ்வாறு எழுதலா: CuSO4.5H2O. இதனை காப்பர் சல்பேட் பென்டாஹைட்ரேட் என அழைக்கலாம். இந்த படிக நீர் காப்பர் சல்பேட்டை நீல நிறமாக மாற்றும். இதனை வெப்பப்படுத்தும் போது நீர் மூலக்கூறுகளை இழந்து வெண்மையாக மாறும்.
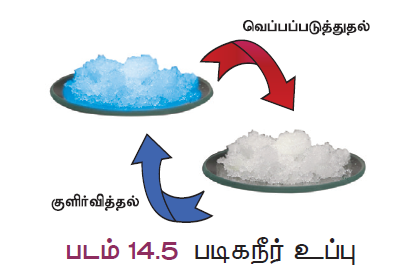
படிக நீர் அற்ற உப்புகள் நீரேற்றம் அற்ற உப்புகள் எனப்படும். இவை தூளாகக் காணப்படும்.
உப்பை அடையாளம் காணுதல்
- இயற் சோதனைகள்: உப்புகளின் நிறம், மணம் மற்றும் அடர்த்தி ஆகியவற்றை அறிதல். இந்த சோதனை நம்பகத்தன்மை அற்றது.
- உலர் வெப்பசோதனை: உலர்ந்த சோதனைக் குழாயில் சிறிதளவு உப்பை எடுத்துக்கொண்டு சூடுபடுத்தவும். நீர் ஆவியான பிறகு, கரையாத உப்புகள் சோதனைக் குழாயின் அடியில் தங்கும்.
- சுடர் சோதனை: சில உப்புகள் அடர் ஹைட்ரோகுளோரிக் அமிலத்துடன் வினைபுரிந்து அவற்றின் குளோரைடுகளைத் தருகின்றன. அடர் ஹைட்ரோகுளோரிக் அமிலத்துடன் கலந்த கலவை பிளாட்டினம் கம்பியின் உதவியோடு சுடரில் காட்டப்படுகிறது.
| சுடரின் நிறம் | காண்பவை |
| செங்கல் சிவப்பு | Ca2+ |
| பொன்னிற மஞ்சள் | Na+ |
| இளஞ்சிவப்பு ஊதா | K+ |
| பச்சை | Zn2+ |
- ஹைட்ரோ குளோரிக் அமிலத்தை, கார்பனேட் உப்புகளுடன் சேர்க்கும் பொழுது, நுரை பொங்கும் கார்பன் டைஆக்சைடு வாயுவைத் தருகிறது.
உப்புகளின் பயன்கள்
சாதாரண உப்பு – சோடியம் குளோரைடு (NaCl)
இது நம் அன்றாட உணவிலும், உணவைப் பாதுகாப்பதிலும் பயன்படுகிறது.
சலவை சோடா – சோடியம் கார்பனேட் (Na2CO3)
- இது கடின நீரை மென்னீராக்கப் பயன்படுகிறது.
- இது கண்ணாடித் தொழிற்சாலை, சோப்பு மற்றும் பேப்பர் தொழிற்சாலைகளில் பயன்படுகிறது.
சமையல் சோடா – சோடியம் பைகார்பனேட் (NaHCO3)
- இது ரொட்டிச் சோடா தயாரிக்கப் பயன்படுகிறது. ரொட்டிச் சோடா என்பது சமையல் சோடாவும், டார்டாரிக் அமிலமும் சேர்ந்த கலவையாகும்.
- இது சோடா – அமில தீயணைப்பான்களில் பயன்படுகிறது.
- கேக் மற்றும் ரொட்டிகளை மென்மையாக மாற்றுகிறது.
- இது அமில நீக்கியில் உள்ள ஒரு பகுதிப்பொருள் இந்தக் கரைசல் காரத் தன்மை பெற்றிருப்பதால் வயிற்றிலுள்ள அதிகப்படியான அமிலத்தை நடுநிலையாக்குகிறது.
சலவைத் தூள் – கால்சியம் ஆக்ஸிகுளோரைடு (CaOCl2)
- கிருமி நாசினியாகப் பயன்படுகிறது.
- பருத்தி மற்றும் லினன் துணிகளை வெளுக்கப் பயன்படுகிறது.
பாரிஸ் சாந்து – கால்சியம் சல்பேட் ஹெமிஹைட்ரேட் (CaSO4. ½ H2O)
- முறிந்த எலும்புகளை ஒட்ட வைப்பதற்குப் பயன்படுகிறது.
- சிலைகளுக்கான வார்ப்புகளைச் செய்யப் பயன்படுகிறது.