அணுக்களும் மூலக்கூறுகளும் Notes 10th Science Lesson 7 Notes in Tamil
அணுக்களும் மூலக்கூறுகளும் Notes 10th Science Lesson 7 Notes in Tamil
அறிமுகம்:
நம்மைச் சுற்றியுள்ள பருப்பொருள்கள் அனைத்தும் அணுக்களால் ஆனவை என்பதை நாம் முன் வகுப்புகளில் படித்துள்ளோம். முதன்முறையாக கி.மு (பொ.ஆ.மு) 5ம் நூற்றாண்டில் கிரேக்கத் தத்துவவியலாளர்கள் அணுவைப் பற்றிய தங்களது கொள்கையை வெளியிட்டனர். அவர்களது கொள்கையானது முற்றிலும் தத்துவம் சார்ந்ததேயன்றி அதற்கு எந்தவித அறிவியல் அடிப்படையும் இல்லை.
ஜான் டால்டன் அணுவைப் பற்றிய முதல் அறிவியல் கோட்பாட்டினை வெளியிட்டார். டால்டனின் சில கோட்பாடுகள் ஜே.ஜே.தாம்சன், ரூதர்போர்டு, நீல்ஸ்போர், ஷிரோடிஞ்சர் (Schrodinger) போன்ற பிந்தைய அறிவியல் அறிஞர்களின் ஆய்வுகளால் தவறு என கண்டறியப்பட்டது. அவர்களது ஆய்வு முடிவுகளின் அடிப்படையில் டால்டன் கோட்பாட்டின் குறைகள் நீக்கப்பட்டு “நவீன அணுக்கொள்கை” என்ற கோட்பாடு முன் மொழியப்பட்டது. நவீன அணுக்கொள்கைகளின் சில முக்கிய கருத்துருக்கள் பின்வருமாறு.
- அணு என்பது பிளக்கக்கூடிய துகள் (எலக்ட்ரான், புரோட்டான் நியூட்ரான் கண்டுபிடிக்குப் பிறகு).
- ஒரே தனிமத்தின் அணுக்கள் வெவ்பேறு அணு நிறைகளைப் பெற்றுள்ளன. (ஐசோடோப்புகளின் கண்டுபிடிப்புகளுக்குப் பிறகு எ.கா: 17Cl35, 17Cl37).
- வெவ்வேறு தனிமங்களின் அணுக்கள் ஒரே அணுநிறைகளைப் பெற்றுள்ளன. (ஐசோபார்களின் கண்டுபிடிப்புகளுக்குப் பிறகு எ.கா: 18Ar40, 20Ca40).
- அணுவை ஆக்கவோ, அழிக்கவோ முடியாது. ஒரு தனிமத்தின் அணுக்களை மற்றொரு தனிமத்தின் அணுக்களாக மாற்றமுடியும். (செயற்கை மாற்று தனிமமாக்கல் முறை).
- அணுவானது எளிய முழு எண்களின் விகிதத்தில் இருக்க வேண்டிய அவசியமில்லை. (எ.கா: குளுக்கோஸ் C6H12O6 C:H:O = 6:12:6 அல்லது 1:2:1 மற்றும் சுக்ரோஸ் C12H22O11 C:H:O = 12:22:11).
- அணு என்பது வேதிவினையில் ஈடுபடும் மிகச்சிறிய துகள்.
- ஒரு அணுவின் நிறையிலிருந்து அதன் ஆற்றலை கணக்கிட முடியும். (E = mc2)
நவீன அணுக்கொள்கையானது அணுக்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகளுக்கு அடிப்படையானது. அணுவைப் பற்றிய அடிப்படைக் கருத்துகளை நீங்கள் முன் வகுப்புகளில் படித்துள்ளீர்கள். தற்போது அணுவைப் பற்றி விரிவாக பார்ப்போம்.
அணு மற்றும் அணு நிறை:
எந்த ஒரு பொருள் நிறை மற்றும் பருமனைப் பெற்றுள்ளதோ, அப்பொருள் பருப்பொருள் எனப்படும். பருப்பொருள்களின் அடிப்படைத் துகள்கள், அணுக்கள் ஆகும். இந்த அணுக்களே பருப்பொருள்களின் நிறைக்குக் காரணம். நவீன அணுக்கொள்கையின் படி அணுவானது எலக்ட்ரான், புரோட்டான், நியூட்ரான் போன்ற உபதுகள்களைத் தன்னுள் கொண்டுள்ளது. இவற்றில் புரோட்டான்களும் நியூட்ரான்களும் குறிப்பிட்டத்தக்க நிறையைப் பெற்றுள்ளன. இவற்றுடன் ஒப்பிடும்போது எலக்ட்ரான்களின் நிறை மிகவும் குறைவு. எனவே ஒரு அணுவின் நிறைக்கு புரோட்டான்களும் நியூட்ரான்களுமே காரணமாக உள்ளன. இதன்படி புரோட்டான்கள் மற்றும் நியூட்ரான்களின் கூடுதலே அந்த அணுவின் “நிறை எண்” எனப்படும்.
தனித்த அணுவானது மிகவும் சிறியது. எனவே அதன் நிறையைக் கணக்கிடுவது மிகவும் சிரமமானது. நாம் பெரும பொருள்களின் நிறையைக் கிராம் மற்றும் கிலோகிராமில் கணக்கிடுவோம். அதுபோல அணுவின் நிறையானது “அணு நிறை அலகினால்” (amu) அளக்கப்படுகிறது.
கார்பன் ஐசோடோப்புகளில் 6 புரோட்டான்களையும் 6 நியூட்ரான்களையும் பெற்றுள்ள C – 12 அணுவின் நிறையில் 12இல் ஒரு பகுதியே அணு நிறை அலகு ஆகும்.
(குறிப்பு: தற்காலத்தில் அணுநிறையைக் குறிப்பிட amu என்ற குறியீட்டிற்கு பதில் ‘U’ என்ற குறியீடு பயன்படுத்தப்படுகிறது. ஏறத்தாழ ஒரு புரோட்டானின் நிறை அல்லது நியூட்ரானின் நிறையானது 1 amu ஆகும்.)
ஒப்பு அணுநிறை (RAM):
அணு என்பது மிகச்சிறியதாக இருப்பதால் அதனுடைய நிறையை நேரடியாகக் கணக்கிட முடியாது. எனவே முற்காலத்தில் அணுநிறையைக் கணக்கிடுவதற்கு, அதனோடு தொடர்புடைய மற்றொரு தனிமத்தின் நிறையோடு ஒப்பிட்டு கணக்கிட்டார்கள். அவர்கள் ஒரே மாதிரியான நிறையைக் கொண்ட இரண்டு அல்லது அதற்கு மேற்பட்ட அணுக்களை ஒரே நேரத்தில் எடுத்துக்கொண்டு, அவற்றில் ஒரு தனிமத்தின் அணுநிறைக்கு குறிப்பிட்ட மதிப்பை அளித்து அதனை திட்ட அளவாகக் கொண்டு, அதனுடன் ஒப்பிட்டு மற்ற தனிமங்களின் அணுநிறைகளைக் கணக்கிட்டனர். இவ்வாறு பெறப்பட்ட அணுநிறை ஒப்பு அணுநிறை எனப்படும். முதலில் ஹைட்ரஜன் அணுவின் நிறையை திட்ட அளவாகக் கொண்டு மற்ற அணுக்களின் நிறைகள் கணக்கிடப்பட்டன. ஹைட்ரஜனின் (1H1, 1H2, 1H3) ஐசோடோப் பண்புகளால் பின்னர் ஹைட்ரஜன் அணுவிற்குப் பதில் ஆக்சிஜன் அணுவானது திட்ட அளவாக எடுத்துக் கொள்ளப்பட்டது. தற்போது, அணுநிறை 12 கொண்ட கார்பனின் நிலைத்த ஐசோடோப்பான C – 12 ஐசோடோப்பானது ஒப்பீட்டு அணு நிறையைக் கணக்கிட திட்ட அளவாக எடுத்துக் கொள்ளப்படுகிறது.
ஒரு தனிமத்தின் ஒப்பு அணுநிறை என்பது அத்தனிமத்தின் ஐசோடோப்புகளின் சராசரி அணு நிறைக்கும் C – 12 அணுவின் நிறையில் 1 / 12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும். இது ‘A’ என்று குறிப்பிடப்படுகிறது. இதனை ‘திட்ட அணு எடை’ எனவும் அழைக்கலாம்.
ஓப்பு அணுநிறை
(Ar) = ஒரு தனிமத்தின் ஐசோடோப்புகளின் சராசரி அணு நிறை / ஒரு C – 12 ன் அணு நிறையில் 1 / 12 பங்கின் நிறை.
அணு நிறையைக் கணக்கிடக்கூடிய நவீன முறையான “நிறை நிறமாலைமானி” முறையில் (mass spectrometric method) C – 12 திட்ட அளவாகப் பயன்படுத்தப்படுகிறது. பெரும்பாலான தனிமங்களில் ஒப்பு அணுநிறையானது முழு எண்களை ஒட்டியே உள்ளதால் கணக்கீட்டிற்கு எளிதாக முழு எண்களாக மாற்றியே பயன்படுத்துகிறோம். சில தனிமங்களின் ஒப்பு அணு நிறைகள் பட்டியலிடப்பட்டுள்ளது.
தனிமங்களின் ஒப்பு அணுநிறை (C – 12 அளவீடு)
| தனிமம் | குறியீடு | Ar |
| ஹைட்ரஜன் | H | 1 |
| கார்பன் | C | 12 |
| நைட்ரஜன் | N | 14 |
| ஆக்சிஜன் | O | 16 |
| சோடியம் | Na | 23 |
| மேக்னீசியம் | Mg | 24 |
| சல்பர் | S | 32 |
சராசரி அணு நிறை (AAM):
ஒரு தனிமத்தின் அணு நிறையை எவ்வாறு கணக்கிடுவாய்? இவற்றைக் கணக்கிடுவது என்பது மிகவும் சிரமம். ஏனெனில் தனிமங்கள் இயற்கையில் பல ஐசோடோப்புகளின் கலவையாக உள்ளன. ஒவ்வொரு ஐசோடோப்பும் தனித்தனி அணுநிறையைக் கொண்டுள்ளது. தனிமத்தின் அணு நிறையைக் கணக்கிடும்பொழுது இந்த ஐசோடோப்புகளைக் கணக்கில் எடுத்துக்கொள்வது அவசியம்.
ஒரு தனிமத்தின் சராசரி அணு நிறை என்பது இயற்கையில் கிடைக்கக்கூடிய கணக்கிடப்பட்ட ஐசோடோப்புகளின் சராசரி நிறையைக் குறிப்பதாகும்.
ஆனால் இயற்கையில் அனைத்து ஐசோடோப்புகளும் ஒரே அளவில் கிடைப்பதில்லை. அணு நிறையைக் கணக்கிடும் போது அனைத்து ஐசோடோப்புகளின் நிறைகள் மற்றும் சதவீத அளவுகள் போன்றவை கணக்கில் எடுத்துக் கொள்ளப்படுகிறது. எனில், சராசரி அணு நிறை என்றால் என்ன? உதாரணமாக 9 amu அணுநிறை உள்ள ஐசோடோப்பு 50 விழுக்காடும் எடுத்துக் கொள்ளப்பட்டால் அதனுடைய சராசரி அணுநிறை கீழ்கண்டவாறு கணக்கிடப்படுகிறது.
சராசரி அணுநிறை:
= (1வது ஐசோடோப்பின் நிறை x 1வது ஐசோடோப்பின் சதவீத அளவு) + (2வது ஐசோடோப்பின் நிறை x 2வது ஐசோடோப்பின் சதவீத அளவு)
எனவே கொடுக்கப்பட்ட தனிமத்தின் சராசரி
அணுநிறை = (9 x 50 / 100) + (10 x 50 / 100)
= 4.5 + 5 = 9.5 amu
(குறிப்பு: கணக்கிடும்போது விழுக்காட்டினை, தசமமாக மாற்றி கணக்கிட வேண்டும். உதாரணமாக 50 விழுக்காடு என்பதை 50 / 100 (அ) 0.50 என்றவாறு கணக்கில் எடுத்துக் கொள்ள வேண்டும்.)
தனிம வரிசை அட்டவணையில் குறிப்பிடப்பட்டுள்ள தனிமங்களின் அணுநிறை என்பது சராசரி அணுநிறையாகும். சில நேரங்களில் அணு எடை என்பது சராசரி அணுநிறையைக் குறிப்பதாகும். தனிம வரிசை அட்டவணையின்படி பெரும்பாலான தனிமங்களின் அணு நிறை என்பது முழு எண்களாக இருப்பதில்லை என அறியப்படுகிறது. உதாரணமாக தனிம வரிசை அட்டவணையில் கார்பனின் அணு நிறை 12.00 amu என்பதற்கு பதிலாக 12.01 amu என்று கொடுக்கப்பட்டுள்ளது. இதற்கு காரணம் கார்பனின் அணுநிறையைக் கணக்கிடும்போது C – 12 மற்றும் C – 13 ன் ஐசோடோப்புகள் கணக்கில் எடுத்துக் கொள்ளப்படுகின்றன. கார்பன் – 12 மற்றும் கார்பன் – 13 ஆகியவற்றின் இயற்கை பரவல்கள் முறையே 98.90% மற்றும் 1.10% ஆகும். கார்பனின் சராசரி அணுநிறை கீழ்க்கண்டவாறு கணக்கிடப்படுகிறது.
கார்பனின் சராசரி அணுநிறை:
= (12 x 98.9 / 100) + (13 x 1.1 / 100)
= (12 x 0.989) + (13 x 0.011)
= 11.868 + 0.143 = 12.011 amu
இதிலிருந்து கார்பனின் அணுநிறை 12 amu என்பது கார்பன் ஐசோடோப்புகளின் சராசரி அணுநிறையே தவிர, தனித்த கார்பனின் அணுநிறை அல்ல.
சில தனிமங்களின் அணுநிறைகள்
| அணு எண் | பெயர் | குறியீடு | அணு நிறை |
| 1 | ஹைட்ரஜன் | H | 1.008 |
| 2 | ஹீலயம் | He | 4.003 |
| 3 | லித்தியம் | Li | 6.941 |
| 4 | பெரிலியம் | Be | 9.012 |
| 5 | போரான் | B | 10.811 |
சராசரி அணுநிறையைக் கணக்கிடுதல்:
எ.கா.கணக்கு 1: பூமியின் மேற்பரப்பு மற்றும் மனித உடலில் அதிகமாகக் காணப்படக்கூடிய தனிமம் ஆக்சிஜன், அது அட்டவணையில் கொடுக்கப்பட்டுள்ளவாறு மூன்ற வகையான நிலைத்த ஐசோடோப்புகளின் கலவையாக உள்ளது.
ஆக்சிஜனின் ஐசோடோப்புகள்
| ஐசோடோப் | நிறை | % பரவல் |
| 8O16 | 15.9949 | 99.757 |
| 8O17 | 16.9991 | 0.038 |
| 8O18 | 17.9992 | 0.205 |
ஆக்சிஜனின் அணு நிறை
= (15.9949 X 0.99757) + (16.9991 X 0.00038) + (17.9992 X 0.00205)
= 15.999 amu.
எ.கா. கணக்கு 2: இயற்கையில் தனிமம் போரான் என்பது போரான் – 10 (5 புரோட்டான்கள் + 5 நியூட்ரான்கள்) மற்றும் போரான் – 11 (5 புரோட்டான்கள் + 6 நியூட்ரான்கள்) ஆகியவற்றின் கலவையாக உள்ளது. B – 10ன் சதவீதபரவல் 20 ஆகவும் B – 11ன் சதவீத பரவல் 80ஆகவும் உள்ளது. எனில் போரானின் சராசரி நிறை கீழ்கண்டவாறு கணக்கிடப்படுகிறது.
போரானின் அணு நிறை.
= (10 x 20 / 100) + (11 x 80 / 100)
= (10 x 0.20) + (11 x 0.80)
= 2 + 8.8
= 10.8 amu
மூலக்கூறு மற்றும் மூலக்கூறு நிறை:
மந்த வாயுக்களைத் தவிர பெரும்பாலான தனிமங்களின் அணுக்களானது அதே தனிமத்தின் அணுக்களுடனோ அல்லது பிற தனிமங்களின் அணுக்களுடனோ இணைந்தே காணப்படும். இதற்கு மூலக்கூறு என்று பெயர். இரண்டு அல்லது அதற்கு மேற்பட்ட அணுக்கள் அவைகளுக்கிடையேயான ஒரு வலுவான வேதிக்கவர்ச்சி விசையால் (வேதிப்பிணைப்பால்) ஒன்றிணைந்து உருவாகக் கூடியது. ஒரு மூலக்கூறு ஆகும்.
மூலக்கூறுகளின் வகைப்பாடுகள்:
இரண்டு அல்லது அதற்கு மேற்பட்ட ஒரே தனிமத்தின் அணுக்களோ அல்லது வெவ்வேறு தனிமங்களின் அணுக்களோ மாறா விகித விதிப்படி, ஒரு குறிப்பிட்ட விகிதத்தில் ஒன்றிணைந்து உருவாவதே மூலக்கூறு எனப்படும். ஆகவே மூலக்கூறு என்பது தனிமமாகவோ அல்லது சேர்மமாகவோ இருக்கலாம். ஒரு மூலக்கூறானது ஒரே தனிமத்தின் அணுக்களால் உருவாக்கப்பட்டால் அது ஒத்த அணு மூலக்கூறு என அழைக்கப்படும். ஒரு மூலக்கூறானது வெவ்வேறு தனிமங்களின் அணுக்களால் உருவாக்கப்பட்டால் அது வேற்றணு மூலக்கூறு என அழைக்கப்படும். மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையே அம்மூலக்கூறின் “அணுக்கட்டு எண்” ஆகும்.
மூலக்கூறுகளின் வகைப்பாடுகள்:
| அணுக்கட்டு எண் | அணுக்களின் எண்ணிக்கை | பெயர் |
| 1 | 1 | ஓரணு |
| 2 | 2 | ஈரணு |
| 3 | 3 | மூவணு |
| > 3 | > 3 | பல அணு |
உதாரணமாக ஆக்சிஜனை எடுத்துக் கொள்வோம். ஆக்சிஜன் வாயு ஆக்சிஜன் (O2), ஓசோன் (O3) ஆகிய இரண்டு புற வேற்றுமை வடிவங்களைக் கொண்டது. ஒரு ஆக்சிஜன் (O2) மூலக்கூறில் இரண்டு ஆக்சிஜன் அணுக்கள் உள்ளன. ஆகவே ஆக்சிஜனின் அணுக்கட்டு எண்: 2, இதில் இரண்டு அணுக்களும் ஒரே மாதிரியாக இருப்பதால் இது “ஒத்த ஈரணு மூலக்கூறு” எனப்படும். ஒத்த ஈரணு மூலக்கூறுகளாகக் காணப்படும் பிற தனிமங்களாவன; ஹைட்ரஜன் (H2), நைட்ரஜன் (N2) மற்றும் ஹாலஜன்: (ஃப்ளுரின் (F2), குளோரின் (Cl2), புரோமின் (Br2), அயோடின் (I2).

ஓத்த அணு மூலக்கூறு
ஒரு ஓசோன் (O3) மூலக்கூறில் மூன்று ஆக்சிஜன் அணுக்கள் உள்ளன. எனவே அது “ஒத்த மூவணு மூலக்கூறு” என அழைக்கப்படுகிறது. ஒரு மூலக்கூறு மூன்றுக்கு மேற்பட்ட அணுக்களைக் கொண்டிருந்தால் அது “பல அணு மூலக்கூறு” எனப்படும்.
உதாரணமாக ஹைட்ரஜன் குளோரைடை எடுத்துக் கொண்டால் அது ஹைட்ரஜன் மற்றும் குளோரின் ஆகிய இரண்டு வெவ்வேறு தனிமங்களின் அணுக்களால் ஆனவை. எனவே இதன் அணுக்கட்டு எண் 2. இது வேற்று ஈரணு மூலக்கூறு ஆகும். அதுபோலவே நீர் மூலக்கூறு இரு ஹைட்ரஜன் அணுக்களையும் ஒரு ஆக்சிஜன் அணுவையும் கொண்டது. எனவே இதன் அணுக்கட்டு எண் 3. இது வேற்று மூவணு மூலக்கூறு ஆகும்.
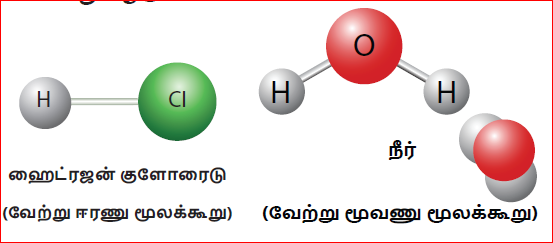
வேற்றணு மூலக்கூறுகள்
ஓப்பு மூலக்கூறு நிறை (RMM):
மூலக்கூறுகள் அனைத்தும் அணுக்களால் ஆனவை, ஆதலால் அதற்கு நிறை உண்டு. ஒரு தனிமம் அல்லது சேர்மத்தின் மூலக்கூறு நிறையானது C – 12 அளவீட்டினைப் பொருத்து அளக்கப்படுவதால் அது ஓப்பு மூலக்கூறு நிறை எனப்படும்.
ஓப்பு மூலக்கூறு நிறை என்பது ஒரு மூலக்கூறின் நிறைக்கும், C – 12 அணுவின் நிறையில் 1 / 12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும்.
ஒரு மூலக்கூறின் ஒப்பு மூலக்கூறு நிறையானது அம்மூலக்கூறில் உள்ள அனைத்து அணுக்களின் ஒப்பு அணுநிறைகளின் கூடுதலுக்குச் சமம்.
ஒப்பு மூலக்கூறு நிறைகளின் கணக்கீடுகள்:
எ.கா.கணக்கு 1: சல்ப்யூரிக் அமிலத்தின் (H2SO4) ஒப்பு மூலக்கூறு நிறையானது கீழ்கண்டவாறு கணக்கிடப்படுகிறது. சல்ப்யூரிக் அமிலமானது இரண்டு ஹைட்ரஜன் அணுக்களாலும் ஒரு சல்பர் அணுவாலும் நான்கு ஆக்சிஜன் அணுக்களாலும் ஆனது.
ஆகவே, சல்ப்யூரிக் அமிலத்தின் ஒப்பு மூலக்கூறுநிறை
= (2 x ஹைட்ரஜனின் நிறை) + (1 x சல்பரின் நிறை) + (4 x ஆக்சிஜனின் நிறை)
= (2 x 1) + (1 x 32) + (4 x 16) = 98
அதாவது ஒரு சல்ப்யூரிக் அமிலத்தின் மூலக்கூறுநிறையானது 1 / 12 பங்கு C – 12 அணுவின் நிறையை விட 98 மடங்கு அதிகமானது.
எ.கா.கணக்கு 2: நீரின் ஒப்பு மூலக்கூறு நிறை கீழ்கண்டவாறு கணக்கிடப்படுகிறது. நீர் மூலக்கூறானது 2 ஹைட்ரஜன் அணுவையும் 1 ஆக்சிஜன் அணுவையும் கொண்டுள்ளது.
நீரின் ஒப்பு மூலக்கூறு நிறை
= (2 x ஹைட்ரஜனின் நிறை) + (1 x ஆக்சிஜனின் நிறை)
= (2 x 1) + (1 x 16) = 18
ஒரு நீர் மூலக்கூறின் நிறையானது 1 / 12 பங்கு C – 12 அணுவின் நிறையை விட 18 மடங்கு பெரியது.
அணுக்கள் மற்றும் மூலக்கூறுகளுக்கிடையேயான வேறுபாடு:
அணுக்கள், மூலக்கூறுகளுடைய அடிப்படைத் துகள்களாக இருந்த போதிலும் இவையிரண்டும் பல பண்புகளில் வேறுபடுகின்றன. அட்டவணையில் அணுக்களுக்கும் மூலக்கூறுகளுக்குமான பல்வேறு வேறுபாடுகள் தொகுக்கப்பட்டுள்ளன.
அணுக்கள் மற்றும் மூலக்கூறுகளுக்கு இடையேயான வேறுபாடுகள்
| அணுக்கள் | மூலக்கூறுகள் |
| ஒரு தனிமத்தின் மிகச் சிறிய பகுதி அணு ஆகும். | தனிமம் அல்லது சேர்மத்தின் மிகச் சிறிய பகுதி மூலக்கூறு ஆகும். |
| மந்த வாயுக்களைத் தவிர ஏனைய அணுக்கள் தனித்த நிலையில் இருப்பதில்லை. | மூலக்கூறுகள் தனித்த நிலையில் இருக்கும். |
| மந்த வாயுக்களைத் தவிர ஏனைய அணுக்கள் வினைத்திறன் மிக்கவை. | மூலக்கூறுகள் வினைத்திறன் குறைந்தவை |
| அணுக்களில் வேதிப் பிணைப்புகள் இல்லை | மூலக்கூறுகளில் வேதிப் பிணைப்புகள் உள்ளன |
மோல் கருத்து:
இதுவரை நாம் பருப்பொருள்களில் உள்ள தனித்த அணுக்கள் மற்றும் மூலக்கூறுகளைப் பற்றிப் படித்தோம். அணு நிறை அலகானது தனிமங்களின் அணுநிறைகளுக்கு இடையேயான ஒரு ஒப்பீட்டு மதிப்பினை வழங்குகிறது. ஆனால் அணுக்கள் மிகச்சிறய நிறையை கொண்டிருப்பதால், அணு நிறை அலகைக் கொண்டு பெரும எண்ணிக்கையிலான அணுக்களின் நிறையைக் கணக்கிடுவது என்பது சரியான முறையல்ல. நாம் பெரும மாதிரிகளின் எண்ணிக்கையை அளவிட பல்வேறு அளவிடும் முறைகளை ஏற்கனவே வழக்கத்தில் கொண்டுள்ளோம். உதாரணமாக ஜோடி (2 உருப்படிகள்) மற்றும் டஜன் (12 உருப்படிகள்) போன்றவை அனைவருக்கும் நன்கு தெரிந்த அலகுகள் ஆகும். அதுபோல அதிக எண்ணிக்கை கொண்ட அணுக்கள் மற்றும் மூலக்கூறுகளைக் குறிப்பிடுவதற்கு ஒரு சிறப்பு அலகு தேவைப்பட்டது. எனவே வேதியியலாளர்கள் அணுக்களையும் மூலக்கூறுகளையும் அளவிடுவதற்கு “மோல்” என்ற அலகைப் பயன்படுத்துகின்றனர். இங்கு மோல் என்ற சொல் துகள்களின் எண்ணிக்கையை மட்டுமே குறிப்பிடுகிறது.
SI அளவீட்டு முறையில் ஒரு மோல் என்பது கார்பன் ஐசோடோப்பின் 12 கி (அல்லது 0.012 கி.கி) நிறையில் உள்ள அணுக்களின் எண்ணிக்கைக்குச் சமமான அடிப்படை துகள்களை (அணுக்கள், மூலக்கூறு மற்றும் பிற) கொண்ட பொருளின் அளவு ஆகும். 12 கி நிறை கொண்ட C – 12 ஐசோடோப்பில் உள்ள அணுக்களின் எண்ணிக்கை சோதனை முறையில் நிர்ணயம் செய்யப்பட்டுள்ளது. இது இத்தாலிய அறிவியல் அறிஞர் அவகாட்ரோ என்பவரால் முன்மொழியப்பட்டதால் அவரது பெயரிலேயே “அவகாட்ரோ எண்” என அழைக்கப்படுகிறது. இதன் மதிப்பு 6.023 x 1023 ஆகும். ஆகவே ஒரு மோல் என்பது 6.023 x 1023 துகள்களால் (மூலக்கூறுகளால்) ஆனது. உதாரணமாக 5 மோல் ஆக்சிஜன் மூலக்கூறுகளில் 5 x 6.023 x 1023 மூலக்கூறுகள் உள்ளன.
மோல் தத்துவம்: மோல் என்பதனை எண்ணிக்கை அலகாகப் பயன்படுத்தி மூலக்கூறுகளின் நிறை மற்றும் பருமனை கணக்கிடும் முறையே மோல் தத்துவம் ஆகும்.
மோல்களின் எண்ணிக்கையானது கிடைக்கப்பெற்ற கீழ்கண்ட பல்வேறு வகையான தரவுகளிலிருந்து பின்வருமாறு கணக்கிடப்படுகிறது.
- அணுக்களின் மோல்களின் எண்ணிக்கை
- மூலக்கூறுகளின் மோல்களின் எண்ணிக்கை
- வாயுக்களின் மோல்களின் எண்ணிக்கை (திட்ட வெப்ப அழுத்த நிலையில் (S.T.P) திட்ட மோலார் பருமன் = 22.4 லிட்டர்)
- அயனிகளின் மோல்களின் எண்ணிக்கை
(குறிப்பு: தி.வெ.அ – திட்ட வெப்பநிலை மற்றும் அழுத்தநிலை என்பது 273.15 K மற்றும் 1 வளிமண்டல அழுத்தத்தைக் குறிக்கும்.)
ஒரு அணுவின் மோல்:
ஒரு மோல் அணு என்பது 6.023 x 1023 அணுக்களைக் குறிப்பிடுவதாகும். இது அந்த அணுவின் கிராம் அணு நிறைக்குச் சமம்.
உதாரணமாக ஒரு மோல் ஆக்சிஜன் அணு என்பது 6.023 x 1023 ஆக்சிஜன் அணுக்களைக் கொண்டது அதன் கிராம் அணுநிறை 16 கி.
ஒரு மூலக்கூறின் மோல்:
ஒரு மோல் மூலக்கூறு என்பது 6.023 x 1023 மூலக்கூறுகளை குறிப்பிடுவதாகும். இது அந்த மூலக்கூறின் கிராம் மூலக்கூறுநிறைக்குச் சமம்.
உதாரணமாக ஒரு மோல் மூலக்கூறு ஆக்சிஜன் என்பது 6.023 x 1023 ஆக்சிஜன் மூலக்கூறுகளைக் கொண்டது. அதன் கிராம் மூலக்கூறு நிறை 32 கி.
மோலார் பருமன்:
திட்ட வெப்ப அழுத்த நிலையில் (S.T.P) ஒரு மோல் வாயுவானது 22.4 லிட்டர் அல்லது 22400 மிலி பருமனை ஆக்கிரமிக்கும். இது மோலார் பருமன் எனவும் அழைக்கப்படும்.
மோல்களின் எண்ணிக்கையைக் கணக்கிடும் பல்வேறு முறைகள்:
மோல்களின் எண்ணிக்கை:
= நிறை / அணு நிறை
= நிறை / மூலக்கூறு நிறை
= அணுக்களின் எண்ணிக்கை / 6.023 x 1023
= மூலக்கூறுகளின் எண்ணிக்கை / 6.023 x 1023

மோல் தத்துவம்
சதவீத இயைபு:
நாம் இதுவரை, கொடுக்கப்பட்ட பருப்பொருள்களில் உள்ள துகள்களின் எண்ணிக்கையைப் பற்றிப் படித்தோம். ஆனால் பெரும்பாலான நேரங்களில் சேர்மங்களில் உள்ள குறிப்பிட்ட தனிமங்களின் சதவீத இயைபு தேவைப்படுகிறது.
சேர்மங்களின் சதவீத இயைபு என்பது 100 கி சேர்மத்தில் உள்ள ஒவ்வொரு தனிமத்தின் நிறையைக் குறிப்பதாகும். உதாரணமாக நீரில் உள்ள ஹைட்ரஜன் மற்றும் ஆக்சிஜனின் சதவீத இயைபை கீழ்கண்டவாறு கணக்கிடலாம்.
தனிமத்தின் நிறை சதவீதம்
= சேர்மத்தில் உள்ள ஒரு குறிப்பிட்ட தனிமத்தின் நிறை / சேர்மத்தின் மூலக்கூறு நிறை x 100
நீரின் மூலக்கூறு நிறை H2O = 2(1) + 16 = 18 கி
ஹைட்ரஜனின் சதவீத இயைபு = 2 / 18 x 100 = 11.11%
ஆக்சிஜனின் சதவீத இயைபு = 16 / 18 x 100 = 88.89%
சதவீத இயைபானது சேர்மங்களின் விகித வாய்பாடு மற்றும் மூலக்கூறு வாய்பாட்டைக் கண்டறிவதில் பயன்படுகிறது.
சதவீத இயைபு கணக்கீடுகள்:
எ.கா.கணக்கு 1: மீத்தேனில் உள்ள தனிமங்களின் சதவீத இயைபை காண்க.
CH4 ன் மூலக்கூறு நிறை = 12 + 4 = 16 கி
கார்பனின் சதவீத இயைபு = 12 / 16 x 100 = 75%
ஹைட்ரஜனின் சதவீத இயைபு = 4 / 16 x 100 = 25%
அவகாட்ரோ கருதுகோள்கள்:
1811 இல் அவகாட்ரோ என்ற அறிவியல் அறிஞர் மூலக்கூறுகளின் எண்ணிக்கைக்கும் அவற்றின் பருமனுக்கும் இடையேயான தொடர்பினை வெவ்வேறு சூழ்நிலைகளில் கண்டறிந்து அவரது கருதுகோள்களை வெளியிட்டார்.
அவகாட்ரோ கூற்றின்படி, “மாறா வெப்ப மற்றும் அழுத்த நிலையில் சம பருமனுள்ள வாயுக்கள் அனைத்தும் சம அளவு எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருக்கும்”.
இதன்படி கொடுக்கப்பட்ட வாயுக்களின் பருமனானது அவ்வாயுவின் மூலக்கூறுகளின் எண்ணிக்கைக்கு நேர்விகிதத்தில் தொடர்புடையதாக இருக்கும். எனில் ‘V’ என்பது பருமனையும் ‘n’ என்பது வாயு மூலக்கூறுகளின் எண்ணிக்கையையும் குறிப்பதாகக் கொண்டால் அவகாட்ரோ விதிப்படி
V α n
V = மாறிலி x n
ஆகவே 1 லி ஹைட்ரஜனில் உள்ள மூலக்கூறுகளின் எண்ணிக்கை 1 லி ஆக்சிஜனில் உள்ள மூலக்கூறுகளின் எண்ணிக்கைக்கு சமமாக இருக்கும். இதன்மூலம் வாயுக்களின் பருமனானது அவற்றின் மூலக்கூறுகளின் எண்ணிக்கைக்கு நேர்விகிதத் தொடர்பு கொண்டது என்பது தெளிவாகிறது.
அவகாட்ரோ கருதுகோள்கள்
விளக்கம்:
ஹைட்ரஜன் மற்றும் குளோரின் இணைந்து ஹைட்ரஜன் குளோரைடு உருவாகும் வினையை எடுத்துக்கொள்வோம்.
H2(வாயு) + Cl2(வாயு) → 2 HCl(வாயு)
1 பருமன் + 1 பருமன் → 2 பருமன்
அவகாட்ரோ விதிப்படி ஒரு பருமனுள்ள வாயுக்கள் அனைத்தும் ‘n’ எண்ணிக்கையிலான மூலக்கூறுகளை பெற்றிருக்கும். எனவே
n மூலக்கூறு + n மூலக்கூறு → 2n மூலக்கூறு
n = 1 எனில்
1 மூலக்கூறு + 1 மூலக்கூறு → 2 மூலக்கூறு
½ மூலக்கூறு + ½ மூலக்கூறு → 1 மூலக்கூறு
1 மூலக்கூறு ஹைட்ரஜன் குளோரைடு என்பது ½ மூலக்கூறு ஹைட்ரஜனையும் ½ மூலக்கூறு குளோரினையும் கொண்டது. இதன் மூலம் மூலக்கூறுகளை பிரிக்க முடியும் என்பது தெளிவாகிறது. இது டால்டனின் அணுக்கொள்கையை ஒத்திருக்கிறது.
அவகாட்ரோ விதியின் பயன்பாடுகள்:
- கே-லூசாக் விதியினை விவரிக்கிறது.
- வாயுக்களின் அணுக்கட்டு எண்ணைக் கணக்கிட உதவுகிறது.
- அவகாட்ரோ விதியினைப் பயன்படுத்தி வாயுக்களின் மூலக்கூறு வாய்பாட்டை கணக்கிடலாம்.
- மூலக்கூறுநிறைக்கும், ஆவி அடர்த்திக்கும் உள்ள தொடர்பை வருவிக்க உதவுகிறது.
- அனைத்து வாயுக்களின் கிராம் மோலார் பருமனை (22.4 லிட்டர் திட்ட வெப்ப அழுத்த நிலையில்) கணக்கிடுவதில் பயன்படுகிறது.
ஆவி அடர்த்திக்கும் ஒப்பு மூலக்கூறு நிறைக்கும் இடையேயான தொடர்பு:
- ஒப்பு மூலக்கூறு நிறை (ஹைட்ரஜன் அளவீடு):
ஒரு வாயு அல்லது ஆவியின் ஒப்பு மூலக்கூறு நிறை என்பது ஒரு மூலக்கூறு வாயு அல்லது ஆவியின் நிறைக்கும் ஒரு ஹைட்ரஜன் அணுவின் நிறைக்கும் இடையே உள்ள விகிதமாகும்.
- ஆவி அடர்த்தி (V.D.) :
மாறா வெப்ப மற்றும் அழுத்த நிலையில் ஒரு குறிப்பிட்ட பருமனுள்ள வாயு அல்லது ஆவியின் நிறைக்கும் அதே பருமனுள்ள ஹைட்ரஜன் அணுவின் நிறைக்கும் உள்ள விகிதமே ஆவி அடர்த்தி எனப்படும்.
ஆவி அடர்த்தி (V.D.) = தி.வெ.அ. நிலையில் குறிப்பிட்ட பருமனுள்ள வாயு (அ) ஆவியின் நிறை / அதே பருமனுள்ள ஹைட்ரஜன் அணுவின் நிறை
அவகாட்ரோ விதிப்படி சமபருமனுள்ள வாயுக்கள் அனைத்தும் சம அளவு எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருக்கும்.
ஒரு பருமனுள்ள வாயுவில் ‘n’ எண்ணிக்கையிலான மூலக்கூறுகள் உள்ளதாகக் கொண்டால்,
ஆவி அடர்த்தி (தி.வெ.அ) = ‘n’ மூலக்கூறு வாயு (அ) ஆவியின் நிறை / ‘n’ மூலக்கூறு ஹைட்ரஜனின் நிறை
‘n’ = 1 எனக் கொண்டால்,
ஆவி அடர்த்தி = 1 மூலக்கூறுவாயு (அ) ஆவியின் நிறை / 1 மூலக்கூறு ஹைட்ரஜனின் நிறை
ஹைட்ரஜன், ஈரணு மூலக்கூறு ஆதலால்
ஆவி அடர்த்தி = 1 மூலக்கூறுவாயு (அ) ஆவியின் நிறை / 2 ஹைட்ரஜன் அணுக்களின் நிறை
நாம் ஆவி அடர்த்தியை மூலக்கூறு நிறையுடன் கீழ்கண்டவாறு தொடர்புபடுத்தலாம்.
ஆவி அடர்த்தி = 1 மூலக்கூறு வாயு (அ) ஆவியின் நிறை / 2 x 1 ஹைட்ரஜன் அணுவின் நிறை ….. 7.1
ஒப்பு மூலக்கூறு நிறை = 1 மூலக்கூறு வாயு (அ) ஆவியின் நிறை / 1 ஹைட்ரஜன் அணுவின் நிறை …… 7.2
சமன்பாடு 7.2 ஐ 7.1 இல் பதிலியிட
ஆவி அடர்த்தி = ஒப்பு மூலக்கூறு நிறை / 2
குறுக்கே பெருக்க
2 x ஆவி அடர்த்தி = வாயு (அ) ஆவியின் ஒப்பு மூலக்கூறு நிறை
(அ)
ஓப்பு மூலக்கூறு நிறை = 2 x ஆவி அடர்த்தி
தீர்க்கப்பட்ட கணக்குகள்:
- மூலக்கூறு நிறை கணக்குகள்:
கீழ்கண்டவற்றின் மூலக்கூறு நிறையைக் காண்க:
- H2O 2) CO2 3) Ca3 4) Ca3(PO4)2
தீர்வுகள்:
1.H2O
H ன் அணு நிறை = 1, O-ன் அணு நிறை =16
H2O ன் மூலக்கூறு நிறை = (1 x 2) + (16 x 1) = 2 + 16
H2O ன் மூலக்கூறு நிறை = 18 கி
2. CO2
C ன் அணு நிறை = 12, O-ன் அணு நிறை = 16
CO2 ன் மூலக்கூறு நிறை = (12 x 1) + (16 x 2) = 12 + 32
CO2 ன் மூலக்கூறு நிறை = 44 கி
3. Ca3(PO4)2
Ca ன் அணு நிறை = 40, P-ன் அணு நிறை = 30,
O ன் அணு நிறை = 16
Ca3(PO4)2 ன் மூலக்கூறு நிறை
= (40 x 3) + [30 + (16 x 4)] x 2
= 120 + (94 x 2)
= 120 + 188
Ca3(PO4)2 ன் மூலக்கூறு நிறை = 308 கி.
- நிறை மற்றும் பருமனைப் பயன்படுத்தி மோல்களைக் கணக்கிடுதல்.
1. 46 கி சோடியத்தின் மோல்களைக் கணக்கிடு
மோல்களின் எண்ணிக்கை = நிறை / அணுநிறை = 46 / 23 = 2 மோல்
2. S.T.P இல் 5.6 லிட்டர் ஆக்சிஜன்
மோல்களின் எண்ணிக்கை = பருமன் / மோலார் பருமன் = 5.6 / 22.4 = 0.25 மோல்
3. 12.046 x 1023 இரும்பின் மோல்களைக் கணக்கிடு
மோல்களின் எண்ணிக்கை = அணுக்களின் எண்ணிக்கை / அவகாட்ரோ எண்
= 12.046 x 1023 / 6.023 x 1023 = 2 மோல்
- மோல்களின் எண்ணிக்கையிலிருந்து நிறையைக் கணக்கிடுதல்.
1. 0.3 மோல் அலுமினியம் (AI ன் அணுநிறை = 27)
மோல்களின் எண்ணிக்கை = நிறை / அணுநிறை
நிறை = மோல்களின் எண்ணிக்கை x அணுநிறை
நிறை = 0.3 x 27 = 8.1 கி
2. S.T.P இல் 2.24 லிட்டர் SO2
மூலக்கூறு நிறை = 32 + (16 x 2) = 32 + 32 = 64 கி
மோல்களின் எண்ணிக்கை = பருமன் / மோலார் பருமன் = 2.24 / 22.4 = 0.1 மோல்
மோல்களின் எண்ணிக்கை = நிறை / அணுநிறை
நிறை = மோல்களின் எண்ணிக்கை x மூலக்கூறு நிறை
நிறை = 0.1 x 64 = 6.4 கி
3. 1.51 x 1023 மூலக்கூறு நீர்
நீரின் மூலக்கூறு நிறை = 18 கி
மோல்களின் எண்ணிக்கை = மூலக்கூறுகளின் எண்ணிக்கை / அவகாட்ரோ எண்
= 1.51 x 1023 / 6.023 x 1023 = 1 / 4 = 0.25 மோல்
நிறை = மோல் x மூலக்கூறு நிறை
நிறை = 0.25 x 18 = 4.5 கி
4.5 x 1023 மூலக்கூறு குளுக்கோஸ்
குளுக்கோஸின் மூலக்கூறு நிறை = 180 கி
நிறை = மூலக்கூறு நிறை x மூலக்கூறுகளின் எண்ணிக்கை / அவகாட்ரோ எண்
நிறை = (180 x 5 x 1023) / 6.023 x 1023 = 149.43 கி
- மூலக்கூறுகளின் எண்ணிக்கை மற்றும் அணுக்களின் எண்ணிக்கையைக் கணக்கிடுதல்.
1. 11.12 லி CO2 இல் உள்ள மூலக்கூறுகளின் எண்ணிக்கையைக் கணக்கிடு.
மோல்களின் எண்ணிக்கை = பருமன் / மோலார் பருமன் = 11.2 / 22.4 = 0.5 மோல்
மூலக்கூறுகளின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை x அவகாட்ரோ எண்
= 0.5 x 6.023 x 1023 = 3.011 x 1023 மூலக்கூறுகள்
2. 1 கி தங்கத்தில் உள்ள அணுக்களின் எண்ணிக்கையைக் கணக்கிடு (Au ன் அணுநிறை = 198 கி)
அணுக்களின் எண்ணிக்கை = நிறை x அவகாட்ரோ எண் / அணுநிறை
அணுக்களின் எண்ணிக்கை = 1 x 6.023 x 1023 / 198 = 3.042 x 1021
3. 54 கி H2O இல் உள்ள மூலக்கூறுகளின் எண்ணிக்கை யாது?
மூலக்கூறுகளின் எண்ணிக்கை = நிறை x அவகாட்ரோ எண் / மூலக்கூறு நிறை
மூலக்கூறுகளின் எண்ணிக்கை = 54 x 6.023 x 1023 / 18 = 18.069 x 1023
4. 5 மோல் CO2 ல் உள்ள கார்பன் மற்றும் ஆக்சிஜன் அணுக்களின் எண்ணிக்கையைக் காண்க.
- 1 மோல் CO2 இல் 2 மோல் ஆக்சிஜன் அணுக்கள் உள்ளது.
- 5 மோல் CO2 இல் 10 மோல் ஆக்சிஜன் அணுக்கள் உள்ளது.
அணுக்களின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை x அவகாட்ரோ எண்
= 10 x 6.023 x 1023 = 6.023 x 1024 ஆக்சிஜன் அணு
- 1 மோல் CO2 இல் 1 மோல் கார்பன் அணுக்கள் உள்ளது.
- 5 மோல் CO2 இல் 5 மோல் கார்பன் அணுக்கள் உள்ளது.
அணுக்களின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை x அவகாட்ரோ எண்.
= 5 x 6.023 x 1023 = 3.011 x 1024 கார்பன் அணு
V. மோலார் பருமன் கணக்குகள் கீழ்கண்டவற்றின் பருமனைக் கணக்கிடு:
1. 2.5 மோல் CO2
பருமன் = மோல்களின் எண்ணிக்கை x மோலார் பருமன்
பருமன் = 2.5 x 22.4 = 56 லிட்டர்
2. 12.046 x 1023 மூலக்கூறு அம்மோனியா
மோல்களின் எண்ணிக்கை = மூலக்கூறுகளின் எண்ணிக்கை / அவகாட்ரோ எண்
= 12.046 x 1023 / 6.023 x 1023 = 2 மோல்
பருமன் = மோல்களின் எண்ணிக்கை x மோலார் பருமன்
பருமன் = 2 x 22.4 = 44.8 லிட்டர்
3. 14 கி நைட்ரஜன் வாயு
மோல்களின் எண்ணிக்கை = 14 / 28 = 0.5 மோல்
பருமன் = மோல்களின் எண்ணிக்கை x மோலார் பருமன்
பருமன் = 0.5 x 22.4 = 11.2 லிட்டர்
VI. சதவீத இயைபு கணக்குகள்:
1. H2SO4 ல் உள்ள S ன் சதவீத இயைபினைக் காண்க:
H2SO4 ன் மூலக்கூறு நிறை
= (1 x 2) + (32 x 1) + (16 x 4)
= 2 + 32 + 64 = 98 கி
சல்பரின் சதவீத இயைபு = சல்பரின் நிறை / H2SO4 ன் மூலக்கூறு நிறை
சல்பரின் சதவீத இயைபு = 32 / 98 x 100 = 32.65%
நினைவில் கொள்க:
- ஒத்த அணு எண்ணையும் வேறுபட்ட நிறை எண்களையும் கொண்ட ஒரே தனிமத்தின் வெவ்வேறு அணுக்கள் ஐசோடோப்புகள் எனப்படும். எ.கா. 17Cl35, 17Cl37.
- ஒத்த நிறை எண்ணையும் வேறுபட்ட அணு எண்களையும் கொண்ட வெவ்வேறு தனிமத்தின் அணுக்கள் ஐசோபார்கள் எனப்படும். எ.கா. (18Ar40, 20Ca40).
- ஒரே நியூட்ரான்களின் எண்ணிக்கையையும், வேறுபட்ட அணு எண்களையும், வேறுபட்ட நிறை எண்களையும் கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும்(6C13,7N14.)
- ஒரு தனிமத்தின் ஒப்பு அணுநிறை என்பது அத்தனிமத்தின் சராசரி அணு நிறைக்கும் C-12 அணுவின் நிறையில் 1/12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும்.
- ஒரு தனிமத்தின் சராசரி அணு நிறை என்பது இயற்கையில் கிடைக்கக்கூடிய அத்தனிமத்தின் ஒவ்வொரு ஐசோடோப்புகளின் சதவீத பரவலை அதன் அணு நிறையால் பெருக்கிக் கிடைக்கும் மதிப்புகளின் கூட்டுத்தொகைக்குச் சமமாகும்.
- ஒப்பு மூலக்கூறுநிறை என்பது ஒரு மூலக்கூறின் நிறைக்கும், C-12 அணுவின் நிறையில் 1/12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும்.
- அவகாட்ரோ கூற்றின்படி, “மாறா வெப்ப மற்றும் அழுத்த நிலையில் சம பருமனுள்ள வாயுக்கள் அனைத்தும் சம அளவு எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டிருக்கும்.”
- மாறா வெப்ப மற்றும் அழுத்த நிலையில் ஒரு குறிப்பிட்ட பருமனுள்ள வாயு அல்லது ஆவியின் நிறைக்கும் அதே பருமனுள்ள ஹைட்ரஜன் அணுவின் நிறைக்கும் உள்ள விகிதமே ஆவி அடர்த்தி எனப்படும்.
- அணுக்கட்டு எண் = மூலக்கூறு நிறை / அணு நிறை
- ஒப்பு மூலக்கூறு நிறை = 2 x ஆவிஅடர்த்தி.
உங்களுக்கு தெரியுமா?
ஒப்பு அணுநிறை என்பது ஒரு விகிதம், எனவே அதற்கு அலகு இல்லை. ஒரு தனிமத்தின் அணு நிறையை கிராமில் குறிப்பிடுவதாகக் கொண்டால் அதற்ககு “கிராம் அணுநிறை” என்றுபெயர்.
ஹைட்ரஜனின் கிராம் அணு நிறை = 1 கி
கார்பனின் கிராம் அணுநிறை = 12 கி
நைட்ரஜனின் கிராம் அணுநிறை = 14 கி
ஆக்சிஜனின் கிராம் அணுநிறை = 16 கி
ஒப்பு மூலக்கூறு நிறை என்பது ஒரு விகிதம். எனவே அதற்கு அலகு இல்லை. ஒரு சேர்மத்தின் மூலக்கூறு நிறையை கிராமில் குறிப்படுவதாகக் கொண்டால் அதற்கு கிராம் மூலக்கூறுநிலை என்பறு பெயர்.
நீரின் கிராம் மூலக்கூறு நிறை = 18 கி
CO2 ன் கிராம் மூலக்கூறு நிறை = 44 கி
NH3 ன் கிராம் மூலக்கூறு நிறை = 17 கி
HCI ன் கிராம் மூலக்கூறு நிறை = 36.5 கி