அணு அமைப்பு Notes 9th Science Lesson 11 Notes in Tamil
அணு அமைப்பு Notes 9th Science Lesson 11 Notes in Tamil
அறிமுகம்
ஒரு குழந்தை பொம்மையினுள் உள்ளதைக் காண விருப்பங்கொள்வதைப்போல, அறிவியலாளர்கள் அணுக்களினுள்ளே உள்ள துகள்கள் என்னவென்பதை கண்டறிந்து, இந்தத் துகள்கள் எவ்வாறு அணுவில் அமைக்கப்பட்டிருக்கின்றன என்பதையும் கண்டுபிடிக்க விரும்பினார்கள். இதனை விளக்குவதற்கு பல அறிவியலாளர்கள் பல்வேறு அணுக்கொள்கைகளை உருவாக்கினார்கள்.
அவற்றுள் டால்டனின் அணுக்கொள்கை மற்றும் ஜே.ஜே. தாம்சனின் கொள்கைகளை நாம் எட்டாம் வகுப்பில் படித்துள்ளோம். மற்ற பிற அணுக்கொள்கைகளையும், அணுக்களின் அடிப்படைத் துகள்களையும் இப்பாடத்தில் பயின்று அத்துகள்கள் அணுக்களில் எவ்வாறு அமைந்துள்ளன என்பதனையும் கற்போம்.
அணுக்கரு கண்டுபிடிப்பு
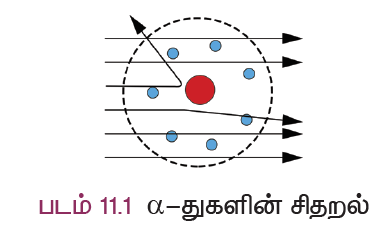
1911 ஆம் ஆண்டில், நியூசிலாந்து நாட்டின் அறிவியலாளர் லார்ட் ரூதர்போர்டு, ஒரு மெல்லிய தங்கத் தகட்டின் மீது மிகச் சிறிய நேர் மின் துகள்களான ஆல்பா கதிர்களை விழச்செய்து தன்னுடைய உலக பிரசித்தி பெற்ற தங்கத்தகடு அணு ஆய்வு சோதனையை நிகழ்த்தினார். தங்கம் எளிதில் தகடாகக் கூடியதாக இருப்பதால் அவர் தங்கத் தகட்டினைத் தேர்ந்தெடுத்தார்.
இச்சோதனையின் போது கீழ்க்கண்டவற்றை அவர் கவனித்தார்:
- பெரும்பாலான ஆல்பா துகள்கள் தங்கத் தகட்டினுள் ஊடுருவி நேர்கோட்டுப் பாதையில் சென்றன.
- சில ஆல்பா துகள்கள் நேர்கோட்டுப் பாதையில் இருந்து சிறு கோணத்தில் விலக்கம் அடைந்தன.
- மிகக் குறைந்த ஆல்பா துகள்கள் வந்த பாதையிலேயே திருப்பி அனுப்பப்பட்டன.
இந்த ஆல்பா துகள்கள் சிதறலடையும் ஆய்வின் முடிவுகளை பொதுமைப்படுத்தி ஒரு அணுக் கொள்கையினை ரூதர்போர்டு உருவாக்கினார், இதுவே ரூதர்போர்டு அணுக் கொள்கை என்று அழைக்கப்படுகிறது.
ரூதர்போர்டு அணுக்கொள்கை
இந்த அணுக்கொள்கையின் முக்கியக் கருத்துக்கள்:
- அணுவின் பெரும்பகுதி வெற்றிடமாக உள்ளது.
- அணுவின் மையத்திலுள்ள அதிக நேர்மின் சுமையுடைய பகுதி உட்கரு எனப்படுகிறது.
- அணுவின் அளவை ஒப்பிடும்போது உட்கருவின் அளவு மிகச்சிறியதாக உள்ளது.
- எலக்ட்ரான்கள் உட்கருவைச் சுற்றி வரும் வட்டப்பாதை ஆர்பிட் என்றழைக்கப்படுகிறது.
- ஒட்டு மொத்தமாக ஒரு அணு நடுநிலை வாய்ந்தது ஆகும். அதாவது, அணுவிலுள்ள புரோட்டான்கள் மற்றும் எலக்ட்ரான்களின் எண்ணிக்கை சமமாக இருக்கும்.

ரூதர்போர்டின் அணு அமைப்பு சூரிய குடும்பத்தின் அமைப்போடு ஒத்துள்ளது. சூரிய குடும்பத்தின் மையத்திலிருக்கும் சூரியனைச் சுற்றி அதன் கோள்கள் சுழல்வதைப்போல ஒரு அணுவின் மையத்திலிருக்கும் உட்கருவினைச் சுற்றியுள்ள ஆர்பிட்டுகளில் அதன் எலக்ட்ரான்கள் சுழல்கின்றன.
ரூதர்போர்டு அணுக் கொள்கையின் வரம்புகள்
மின்காந்தக் கொள்கைப்படி, வேகமாக இயங்கிக் கொண்டிருக்கும் எலக்ட்ரான் தொடர்ந்து ஆற்றலை இழக்க வேண்டும். இவ்வாறு ஆற்றலை இழப்பதால், எலக்ட்ரான் அணுக்கருவைச் சுற்றிவரும் பாதை சுருங்கி இறுதியில் அணுக்கருவினுள் விழ வேண்டும். இவ்வாறு நிகழ்ந்தால் அணு அதன் நிலைப்புத்தன்மையை இழக்க நேரிடும். ஆனால் அணு நிலைப்புத் தன்மை உடையது. இதனால் ரூதர்போர்டு கொள்கை அணுவின் நிலைப்புத் தன்மையை விளக்க இயலவில்லை.

போரின் அணுக் கொள்கை
1913-ஆம் ஆண்டில், டென்மார்க் நாட்டைச் சேர்ந்த நீல்ஸ்போர் எனும் இயற்பியலாளர், அணுவின் நிலைப்புத் தன்மையை நியாயப்படுத்துவதற்காக புதிய அணுக் கொள்கையினை உருவாக்கினார். அதன் முக்கியக் கருத்துக்கள்:
- ஓர் அணுவில் எலக்ட்ரான்கள் நிலையான வட்டப்பாதையில் அணுக்கருவைச் சுற்றி வருகின்றன. இவ்வட்டப் பாதைகள் ஆர்பிட்டுகள் அல்லது ஆற்றல் மட்டங்கள் என அழைக்கப்படுகின்றன.
- ஒரே வட்டப்பாதையில் எலக்ட்ரான்கள் சுற்றி வருகையில் ஆற்றலை இழப்பதோ அல்லது ஏற்பதோ இல்லை.
- ஒரு ஆற்றல் மட்டத்திலிருக்கும் எலக்ட்ரான் உயர் அல்லது குறைந்த ஆற்றல் மட்டத்திற்கு நகரும்போது ஆற்றலை ஏற்கவோ அல்லது இழக்கவோ செய்யும்.
- இவ்வட்டப்பாதைகள் 1,2,3,4 அல்லது K,L,M,N எனப் பெயரிடப்படுகின்றன.
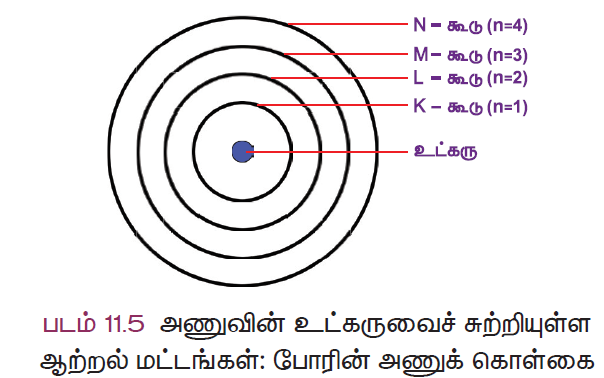
உட்கருவிற்கு அருகாமையில் இருக்கும் K கூடு (n= 1) குறைந்த ஆற்றலை உடையது. L, M, N ……. ஆகியன அடுத்தடுத்த உயர் ஆற்றல் மட்டங்கள் ஆகும். உட்கருவிலிருந்து தொலைவு அதிகரிக்கும் போது, ஆர்பிட்டின் ஆற்றலும் அதிகரிக்கிறது. ஒவ்வொரு ஆர்பிட்டும் நிலையான ஆற்றல் அளவினைப் பெற்றிருப்பதால், அவற்றை ஆற்றல் நிலை அல்லது ஆற்றல் மட்டங்கள் என போர் அழைத்தார்.
போர் அணுக் கொள்கையின் குறைபாடுகள்
ஹைட்ரஜன் மற்றும் ஹைட்ரஜன் போன்ற (He+, Li2+, Be3+) அயனிகளுக்கு மட்டுமே போரின் அணுக்கொள்கை பொருந்தியது. இந்த அணுக்கொள்கை, பல எலக்ட்ரான்களை உடைய அணுக்களுக்கு விரிவாக்கம் செய்யப்படவில்லை.
நியூட்ரான் கண்டுபிடிப்பு
1932 இல் ஜேம்ஸ் சாட்விக் என்னும் அறிவியலார் பெரிலியம் உட்கருவை ஆல்ஃபா கதிரால் தாக்கும்போது புரோட்டான்களுக்கு இணையான நிறை உள்ள துகள்கள் வெளியேறுவதைக் கண்டறிந்தார்.
பெரிலியம் + ஆல்ஃபா கதிர் கார்பன் + நியூட்ரான்
இத்துகள்களுக்கு மின்சுமை ஏதும் இல்லை. இவை நியூட்ரான்கள் என்று அழைக்கப்பட்டன. நியூட்ரான்கள் 0n1 என குறிக்கப்படுகின்றன.
நியூட்ரான்களின் பண்புகள்
- இத்துகள் மின் அல்லது காந்தப் புலத்தினால் விலக்கமடைவதில்லை. எனவே, இது ஒரு மின்சுமையற்ற நடுநிலையான துகளாகும்.
- அதன் நிறை 1.676 x 10-24 கி (1 amu) ஆகும்.
1920-ஆம் ஆண்டு அணுவின் உட்கருவில் நடுநிலைத்தன்மை உடைய துகள் ஒன்று உள்ளது என ரூதர்போர்டு தீர்மானித்தார். ஜேம்ஸ் சாட்விக் நியூட்ரானைக் கண்டறிந்தார். இவர் ரூதர்போர்டின் மாணவன்.
அடிப்படைத் துகள்களின் பண்புகள்
ஒரு அணு பல்வேறு அடிப்படைத் துகள்களினால் கட்டமைக்கப்பட்டுள்ளது. எனினும், எலக்ட்ரான், புரோட்டான் மற்றும் நியூட்ரான் ஆகிய மூன்று அடிப்படைத் துகள்களும் அணுவின் அமைப்பினைப் புரிந்து கொள்வதில் பெரும் பங்காற்றுகின்றன. அவற்றின் பண்புகள் கீழே அட்டவணைப் படுத்தப்பட்டுள்ளன.
அடிப்படைத் துகள்களின் பண்புகள்
| துகள் | குறியீடு | மின்சுமை (மின்னலகு) | நிறை (amu) | நிறை (grams) |
| எலக்ட்ரான் | -1e0 | -1 | 1/1837 | 9.1 x 10-28 |
| புரோட்டான் | 1H1 | +1 | 1 | 1.6 x 10-24 |
| நியூட்ரான் | 0n1 | 0 | 1 | 1.6 x 10-24 |
ஒரு அணுவில் இரண்டு கட்டமைப்புப் பாகங்கள் உள்ளன. அவை உட்கரு மற்றும் வெற்றிட இடைவெளிகளிலுள்ள கற்பனைப் பாதைகளான ஆர்பிட்டுகளாகும்.
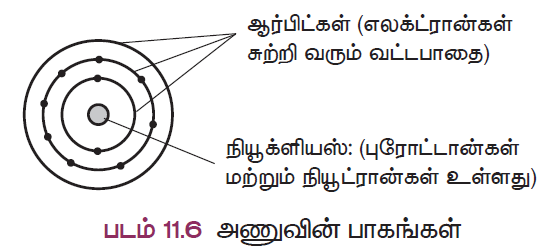
நியூக்ளியஸ் : ஒரு அணுவின் உட்கருவில் புரோட்டான்கள் மற்றும் நியூட்ரான்கள் (கூட்டாக நியூக்ளியான்கள்) காணப்படுகின்றன.
ஆர்பிட் : எலக்ட்ரான்கள் உட்கருவினைச் சுற்றி வரும் வட்டப்பாதை ஆர்பிட் எனப்படும்.
அணுவின் அடிப்படைத் துகள்களான புரோட்டான்கள், நியூட்ரான்கள், எலக்ட்ரான்கள் நீங்கலாக, அணுவின் உட்கருவில் உள்ள பிற அடிப்படைத் துகள்களாவன: மெசான்கள், நியூட்ரினோக்கள், ஆன்டிநியூட்ரினோக்கள், பாசிட்ரான்கள்.
அணு எண் (Z) மற்றும் நிறை எண் (A)
ஹைட்ரஜன் அணுவின் உட்கருவில் ஒரு புரோட்டான் மட்டுமே உள்ளது. ஹீலியம் அணுவில் இரண்டு புரோட்டான்கள் உள்ளன. தங்கத்தின் அணுவில் 79 புரோட்டான்கள் உள்ளன. எனவே, அஉவின் உட்கரிவிலிருக்கும் புரோட்டான்களின் எண்ணிக்கையே, அது எவ்வகைத் தனிமம் என்பதனை நிர்ணயிக்கிறது. இத்தகைய முக்கியத்துவம் வாய்ந்த எண் அணு எண் (புரோட்டான் எண்) எனப்படுகிறது.
அணு எண் = புரோட்டான் எண்ணிக்கை = எலக்ட்ரான் எண்ணிக்கை
ஒரு அணுவின் மொத்த நிறையினை புரோட்டான்கள் மட்டுமே நிர்ணயிப்பதில்லை. நியூட்ரான்களும் உட்கருவில் மொத்த நிறைக்கு பங்களிக்கிறது. அணுவின் மொத்த நிறையை ஒப்பிடும் போது மிகக் குறைந்த நிறையைப் பெற்றுள்ள எலெக்ட்ரானின் நிறை புறக்கணிக்கத்தக்கது. புரோட்டான்கள் மற்றும் நியூட்ரான்களின் நிறை சமமாக இருப்பதால், ஒரு குறிப்பிட்ட அணுவின் மொத்த நிறை இவ்விரண்டு நிறைகளின் கூட்டு மதிப்பாகும். இக்கூட்டு மதிப்பே ஒரு அணுவின் நிறை எண் (அல்லது நியூக்ளியான் எண்) என்று அழைக்கப்படுகிறது.
நிறை எண் = புரோட்டான் எண்ணிக்கை + நியூட்ரான் எண்ணிக்கை
எந்த ஒரு தனிமத்திலும், அணு எண் தனிமத்தின் குறியீட்டிற்கு கீழேயும், நிறை எண் மேலேயும் குறிப்பிடப்படுகிறது.
எடுத்துக்காட்டாக, நைட்ரஜனின் குறியீடு 714N
நைட்ரஜனின் அணு எண் = 7
நைட்ரஜனின் நிறை எண் = 14
ஒரு தனிமத்திலுள்ள அணுவின் நிறை எண் மற்றும் அணு எண்ணின் வேறுபாடு, அத்தனிமத்தின் அணுவிலுள்ள நியூட்ரான்களின் எண்ணிக்கையை வழங்குகிறது.
நியூட்ரான்களின் எண்ணிக்கை (n) = நிறை எண் (A) – அணு எண் (Z)
எடுத்துக்காட்டாக, 1214Mg – இல் உள்ள
நியூட்ரான்களின் எண்ணிக்கை (n) = 24 (A) – 12 (Z) = 12
அணு எண் ‘Z’ வடிவத்தில் ஏன் வடிவமைக்கப்பட்டுள்ளது?
‘Z’ என்றால் ஸ்ஸாஃல் (Zahl) ஜெர்மானிய மொழியில் ‘எண்’ என்று பொருள். ‘Z’ என்பதை அணுஸ்ஸாஃல் (atom Zahl) அல்லது அணு எண் எனலாம். ‘A’ என்கின்ற குறியீடு M, ஜெர்மானிய மொழியில் மாசென்ஸ்ஸால் (massenzahl) என்கிற குறியீட்டுக்குப் பதிலாக, ACS வழிமுறையில் அறிமுகம் செய்யப்பட்டுள்ளது.
அணுக்களின் எலக்ட்ரான் பகிர்வு
எலக்ட்ரான்கள் ஆர்பிட் எனப்படும் வட்டப்பாதைகளில் உட்கருவைச் சுற்றி வருகின்றன என்பதை நீ அறிவாய். ஆர்பிட்டுகள் ஒவ்வொன்றிற்கும் எலக்ட்ரான்களைப் பகிர்ந்து நிரப்புதல் எலக்ட்ரான் பகிர்வு எனப்படும். அணுக்களில் உள்ள இந்த ஆர்பிட்டுகளில் எலக்ட்ரான்கள் பகிர்ந்து நிரப்பப்படுவது, குறிப்பிட்ட விதிகள் (அ) நிபந்தனைகளுக்குட்பட்டே நிகழ்கிறது. இவ்விதிகள் எலக்ட்ரான் அமைப்புக்கான போர் மற்றும் புரி விதிகள் என்று அழைக்கப்படுகின்றன.
அணுவின் கூடுகளில் எலக்ட்ரான் பங்கீட்டுக்கான விதிகளை போர் மற்றும் புரி ஆகியோர் பின்வருமாறு முன் மொழிந்தனர்.
விதி (1): ஒரு வட்டப்பாதையில் இடங்கொள்ளும் அதிகபட்ச எலக்ட்ரான்களின் எண்ணிக்கை 2n2 என்ற வாய்ப்பாட்டால் கணக்கிடப்படுகிறது. n என்பது முதன்மை குவாண்டம் எண் ஆகும். (அதாவது உட்கருவிலிருந்து கூட்டின் வரிசை எண்)
| ஆர்பிட் | n இன் எண்ணிக்கை | எலக்ட்ரான் எண்ணிக்கை 2n2 |
| K | 1 | 2 x 12 = 2 |
| L | 2 | 2 x 22 = 8 |
| M | 3 | 2 x 32 = 18 |
| N | 4 | 2 x 42 = 32 |
விதி (2): கூடுகள் அவற்றின் ஆற்றல்களின் ஏறு வரிசையில் எலக்ட்ரான்களால் படிப்படியாக நிரப்பப்படுகின்றன.
விதி (3): ஒரு அணுவின் வெளிவட்ட ஆர்பிட்டினால் கூடுதலாக எலக்ட்ரான்களைப் பெற முடிந்தாலும், இந்த ஆர்பிட்டில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை 8க்கு மிகாமல் இருக்க வேண்டும். எடுத்துக்காட்டாக, 20 எலக்ட்ரான்களைக் கொண்ட கால்சியம் அணுவின் எலக்ட்ரான் பகிர்வு,
K L M N
2 8 8 2
புரோட்டான்களையும் நியூட்ரான்களையும் இணைக்கும் விசையானது ஈர்ப்பு விசையைக் காட்டிலும் மிகவும் வலிமையானது. இது யுகாவா விசை என அழைக்கப்படுகிறது.
தனிமங்களின் அணு அமைப்பின் வரைபட விளக்கம்
எடுத்துக்காட்டு
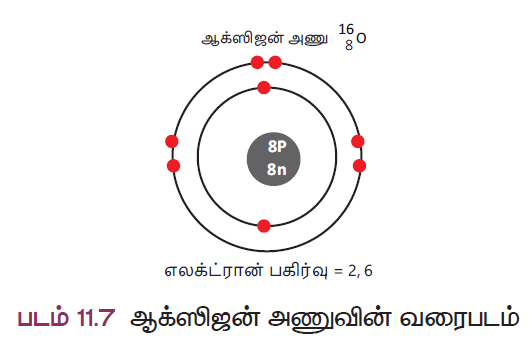
816O – ஆக்சிஜன் அணுவின் வரைபட விளக்கம்
நிறை எண் A = 16
அணு எண் Z = 8
நியூட்ரான்களின் எண்ணிக்கை = A – Z = 16 – 8 = 8
புரோட்டான்களின் எண்ணிக்கை = 8
எலக்ட்ரான்களின் எண்ணிக்கை = 8
எலக்ட்ரான் பகிர்வு = 2 , 6
அணுக்கள் மிக நுண்ணிய நிறை எண்களைப் பெற்றுள்ளதால் அவற்றை கிராமில் அளவிட முடியாது. அவை amu (அணு நிறை அலகு) என்றும் அளவிடப்படுகின்றன. இதன் புதிய அலகு U. அணுவின் உருவ அளவு நானோமீட்டர் என்ற அலகினால் அளவிடப்படுகின்றது (1 nm = 10-9 m). அணுக்கள் மிகவும் நுண்ணிய பொருளாக உள்ளதால் அவை ஸ்கேனிங் எலக்ட்ரான் மைக்ரோஸ்கோப் (SEM) மூலம் பார்வையிடப்படுகின்றன.
இணைதிறன் எலக்ட்ரான்
மேலே உள்ள எடுத்துக்காட்டில் (படம் 11.7) ஆக்சிஜன் அணுவின் வெளிவிட்ட ஆர்பிட்டில் ஆறு எலக்ட்ரான்கள் உள்ளன என்பதை நாம் காணலாம். இந்த ஆறு எலக்ட்ரான்கள் இணைதிறன் எலக்ட்ரான்கள் என அழைக்கப்படுகின்றன.
அணுவின் உட்கருவிலிருந்து கடைசியாக உள்ள வெளிக்கூடு இணைதிறன் கூடு என்றும், அதில் உள்ள எலக்ட்ரான்கள் இணைதிறன் எலக்ட்ரான்கள் என்றும் அழைக்கப்படுகின்றன. தனிமங்களின் வேதிப்பண்புகள் அவற்றின் இணைதிறன் எலக்ட்ரான்களால் தீர்மானிக்கப்படுகின்றன. ஏனெனில் அவை மட்டுமே வேதி வினையில் பங்கெடுக்கின்றன.
வெளிவட்டப்பாதையில் சம எண்ணிக்கையில் எலக்ட்ரான்களை உடைய தனிமங்கள் ஒரே மாதிரியான பண்புகளைக் கொண்டிருக்கும். வேறுபட்ட எண்ணிக்கையில் இணைதிறன் எலக்ட்ரான்களை உடைய தனிமங்கள் வெவ்வேறு பண்புகளைக் கொண்டிருக்கும்.
1,2 அல்லது 3 இணைதீறன் எலக்ட்ரான்களை உடைய தனிமங்கள் (ஹைட்ரஜனைத் தவிர்த்து) உலோகங்கள் எனப்படுகின்றன. வெளிக்கூட்டில் 4 முதல் 7 எலக்ட்ரான்கள் வரை கொண்ட தனிமங்கள் அலோகங்கள் எனப்படுகின்றன.
இணைதிறன்
ஒரு தனிமத்தின் இணை திறன் என்பது அத்தனிமம் மற்றொரு தனிமத்துடன் சேரும் திறனின் அளவு ஆகும். மேலும் அது வேதிவினையில் பங்கு பெறும் எலக்ட்ரான் எண்ணிக்கைக்கு சமமாக இருக்கும். 1,2,3,4 போன்ற இணைதிறன் எலக்ட்ரான்களை உடைய தனிமங்களின் இணைதிறன் 1,2,3,4 ஆகவே இருக்கும். ஒரு தனிமத்தின் இணைதிறன் எலக்ட்ரான்கள் 5,6,7 ஆக இருந்தால் அதன் இணைதிறன் 3,2,1 ஆகவே இருக்கும். அதாவது அணு நிலைப்புத்தன்மையை அடையத் தேவையான 8 எலக்ட்ரான்களைப் பெற முறையே, 3,2,1 எலக்ட்ரான்கள் தேவைப்படுகின்றன. அணுவின் வெளிக்கூடு முழுமையாக எலக்ட்ரான்களால் நிரப்பப்பட்டிருப்பின், அத்தனிமத்தின் இணைதிறன் பூஜ்ஜியம் ஆகும்.
எ.கா. நியானின் எலக்ட்ரான் வடிவமைப்பு 2,8 (முடிவு பெற்றது). அதனால், அதன் இணைதிறன் பூஜ்ஜியம் ஆகும்.

ஐசோடோப்புகள், ஐசோபார்கள் மற்றும் ஐசோடோன்கள்
ஐசோடோப்புகள்
இயற்கையில், சில தனிமங்களின் அணுக்கள் ஒரே அணு எண்ணையும் வெவ்வேறு நிறை எண்ணையும் பெற்றிருப்பது அடையாளம் காணப்பட்டுள்ளது. எடுத்துக்காட்டாக, ஹைட்ரஜன் அணுவின் மூன்று விதமான அணுக்கள் கீழே காண்பிக்கப்பட்டுள்ளன.
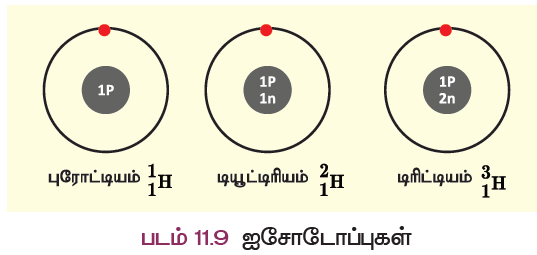
இம்மூன்று அணுக்களின் அணு எண் 1, ஆனால் நிறை எண் முறையே 1, 2 மற்றும் 3 ஆகும். இவை ஐசோடோப்புகள் என்று அழைக்கப்படுகின்றன. மேலும் சில எடுத்துக்காட்டுகள்:
- கார்பன் 612C, 613C
- குளோரின் 1735Cl, 1737Cl
இந்த எடுத்துக்காட்டுகளின் அடிப்படையில் ஐசோடோப்பு என்பது, ஒத்த அணு எண்ணையும், வேறுபட்ட நிறை எண்ணையும் கொண்ட ஒரு தனிமத்தின் வெவ்வேறு அணுக்கள் எனப்படுகிறது. இவை இருவகைப்படும்: நிலைப்புத்தன்மை உடையவை மற்றும் நிலைப்புத் தன்மையற்றவை. ஐசோடோப்புகளின் நிலையற்ற தன்மைக்குக் காரணம் அவற்றின் அணுக்கருவிலுள்ள கூடுதல் நியூட்ரான்களாகும். இவ்வகை ஐசோடோப்புகள் கதிரியக்கத் தன்மையைப் பெற்றிருப்பதால், அவை கதிரியக்க ஐசோடோப்புகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டாக, அணுக்கரு உலையின் மூலமாகிய யுரேனியம் -235 மற்றும் கதிர்வீச்சு சிகிச்சையில் பயன்படுத்தப்படும் கோபால்ட் -60 ஆகியவை கதிரியக்க ஐசோடோப்புகள் ஆகும்.
ஐசோபார்கள்
கால்சியம் (அணு எண் 20) மற்றும் ஆர்கான் (அணு எண் 18) ஆகியவற்றைக் கருதுவோம்.
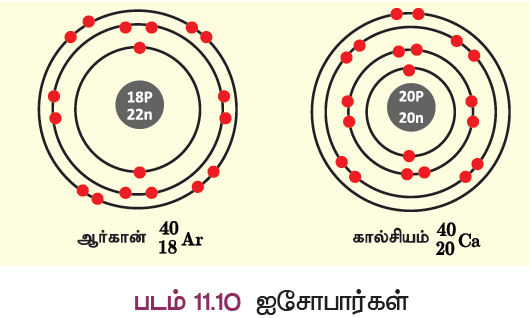
இவற்றில் வெவ்வேறு எண்ணிக்கையில் புரோட்டான்கள் மற்றும் எலக்ட்ரான்கள் உள்ளன. ஆனால், இவ்விரண்டு தனிமங்களின் நிறை எண் 40 ஆகும். ஆகையால், இவற்றின் நியூக்ளியான் எண்ணும் ஒத்த அளவினைப் பெற்றுள்ளது. இவை ஐசோபார்கள் எனப்படும். இவ்வாறாக ஒத்த நிறை எண்களையும் வேறுபட்ட அணு எண்களையும் கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோபார்கள் எனப்படும்.
கட்டை விரல் விதியைப் பயன்படுத்தி t என்பது மேலே எனவும், b என்பது கீழே எனவும் கோள்வோம். ஐசோடோப்புகள்: மேலே உள்ள நிறைஎண் மாறியிருத்தல், ஐசோபார்கள் : கீழே உள்ள அணு எண் மாறியிருத்தல்.
ஐசோடோன்கள்
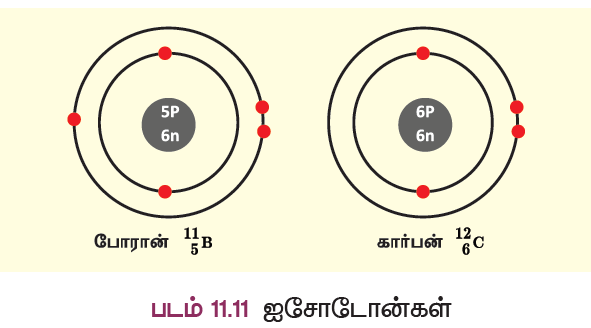
போரானிலுள்ள நியூட்ரான்களின் எண்ணிக்கை = 11 – 5 = 6
கார்பனிலுள்ள நியூட்ரான்களின் எண்ணிக்கை = 12 – 6 = 6
மேற்கண்ட தனிமங்களான போரான், கார்பன் ஆகியவை ஒத்த எண்ணிக்கையில் நியூட்ரான்களைப் பெற்றுள்ளன. ஆனால் புரோட்டான் எண்ணிக்கை வேறுபடுவதால் அவற்றின் அணு எண்களும் வேறுபடுகின்றன. இவ்வாறாக ஒத்த நியூட்ரான் எண்ணிக்கை கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும்.
வேதிச் சேர்க்கை விதிகள்
17-ஆம் நூற்றாண்டில் அறிவியலாளர்கள் ஒரு பொருளை மற்றொரு பொருளாக மாற்றும் முறைகளைக் கண்டறிய முற்பட்டனர். வேதி மாற்றத்தைப் பற்றிய ஆய்வின் பொழுது சில முக்கியக் கருத்துக்களைப் பொதுமைப்படுத்தினர். இப்பொதுமைப்படுத்தப்பட்ட கருத்துக்களே சேர்க்கை விதிகள் ஆகும். அவைகளானவை:
- நிறை மாறா விதி.
- மாறா விகித விதி.
- பெருக்கல் விகித விதி.
- தலைகீழ் விகித விதி.
- கேலூசாக்கின் பருமன் இணைப்பு விதி.
இந்த ஐந்து விதிகளில், இரண்டு விதிகளைப் பற்றி ஏற்கனவே நீங்கள் அறிந்திருப்பீர்கள். மேலும் உள்ள மூன்று விதிகளைப் பற்றி இப்பாடப்பகுதியில் விளக்கமாகக் காண்போம்.
பெருக்கல் விகித விதி
இந்த விதியானது 1804 ஆம் ஆண்டில் ஜான் டால்டன் என்பவரால் முன்மொழியப்பட்டது.
இவ்விதியின் கூற்றுப்படி, A மற்றும் B என்ற இரண்டு தனிமங்கள் ஒண்றாகச் சேர்ந்து, ஒன்றுக்கும் மேற்பட்ட சேர்மகளை உருவாக்கும் பொழுது, A-ன் நிறையானது B-ன் நிறையோடு எளிய விகிதத்தில் சேர்ந்திருக்கும்.
இதனை விளக்குவதற்கு கீழ்க்கண்ட எடுத்துக்காட்டைக் காண்போம்.
கார்பன், ஆக்சிஜன் உடன் இணைந்து கார்பன் மோனாக்சைடு (CO) மற்றும் கார்பன் டைஆக்டைடு (CO2) என்றைரு ஆக்சைடுகளைத் தருகிறது.
ஒரு குறிப்பிட்ட நிறையுள்ள கார்பனுடன், ஆக்சிஜன் இணைந்து உருவாகும் கார்பன் மோனாக்சைடு (CO) மற்றும் கார்பன் டைஆக்சைடு (CO2) ஆகியவற்றில் உள்ள ஆக்சிஜனின் நிறை விகிதம் 1:2.
| சேர்மம் | கார்பனின் நிறை (கி) | ஆக்சிஜனின் நிறை (கி) | நிறை விகிதங்கள்
C : O |
| CO | 12 | 16 | 1 : 2 |
| CO2 | 12 | 32 |
மேலும் ஒரு எடுத்துக்காட்டை எடுத்துக் கொள்வோம். சல்ஃபர், ஆக்சிஜனுடன் வினை புரிந்து சல்ஃபர் டைஆக்சைடு மற்றும் சல்ஃபர் ட்ரைஆக்சைடை உருவாக்கும். SO2 மற்றும் SO3 ஆகியவற்றில் உள்ள ஆக்சிஜனின் நிலையான நிறை விகிதம் 2 : 3.
தலைகீழ் விகித விதி
ஜெர்மியஸ் ரிச்சர் (1792) என்பவர் தலைகீழ் விகித விதியைப் பற்றிக் கூறினார்.
இவ்விதியின் கூற்றுப்படி, “இரண்டு மாறுபட்ட தனிமங்கள் தனித்தனியே ஒரே நிறையுள்ள மூன்றாவது தனிமத்துடன் சேரும்போது, அவற்றின் நிறைகளின் விகிதம் சமமாகவோ அல்லது எளிய பெருக்கல் விகிதத்திலோ இருக்கும்”.
கீழே கொடுக்கப்பட்டுள்ள மூன்று தனிமங்களான ஹைட்ரஜன், ஆக்சிஜன், மற்றும் கார்பனை கருத்தில் கொள்வோம்.
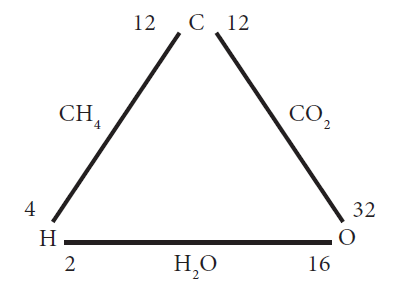
இங்கு, ஹைட்ரஜன் மற்றும் ஆக்சிஜன் ஒத்த நிறையுள்ள கார்பனுடன் வினைபுரிந்து மீத்தேன் (CH4) மற்றும் கார்பன் டைஆக்சைடைத் (CO2) தருகிறது.
| சேர்மங்கள் | இணையும் தனிமங்கள் | இணையும் நிறை | ||
| CH4 | C | H | 12 | 4 |
| CO2 | C | O | 12 | 32 |
(1)
இதேபோல், ஹைட்ரஜனும் ஆக்ஸிஜனும் இணைந்து நீரினை (H2O) உருவாக்குகின்றன.
ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் நிறைகளின் விகிதம் = 2 : 16 (or) 1 : 8 (2)
- மற்றும் (2) ஆகியவற்றின் விகிதங்கள் சமமாக உள்ளன. எனவே, தலைகீழ் விகித விதி நிரூபிக்கப்பட்டுள்ளது.
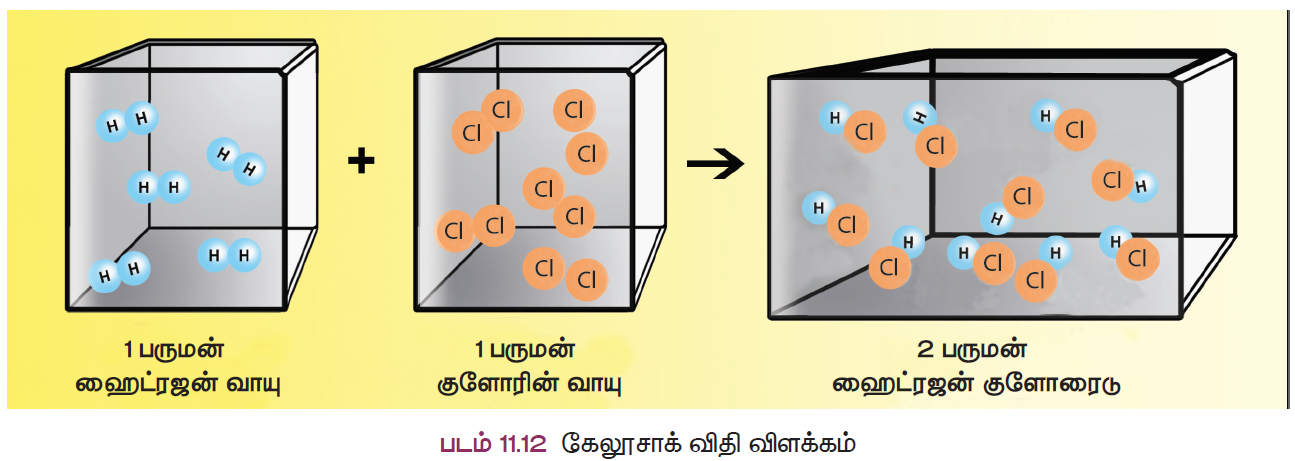
கேலூசாக்கின் பருமன் இணைப்பு விதி
வாயுக்கள் வினைபுரியும் போது, அவற்றின் பருமன்கள் அவ்வினையின் விளைபொருள்களின் பருமனுக்கு எளிய முழு எண் விகிதத்தில் இருக்கும் (வாயுக்களின் பருமன்கள் ஒரே வெப்பநிலை மற்றும் அழுத்தத்தில் அளவிடப்படும் பட்சத்தில்).
ஒரு பருமன் ஹைட்ரஜன் வாயுவானது, ஒரு பருமன் குளோரின் வாயுவுடன் வினைபுரிந்து இரண்டு பருமன் ஹைட்ரஜன் குளோரஒடு சேர்மத்தைத் தருகிறது. இது பருமனில் 1 : 1: 2 என்ற எளிய முழு எண் விகிதத்தில் உள்ளது.
குவாண்டம் எண்கள்
அணுவில் உள்ள ஒவ்வொரு எலக்ட்ரானின் தனித்தன்மை அதன் நான்கு குவாண்டம் எண்களின் அடிப்படையிலேயே அமையும்.
| குவாண்டம் எண் | குறியீடு | அறிந்து கொள்ளுதல் |
| முதன்மை குவாண்டம் எண் | n | முதன்மை ஆற்றல் மட்டம் |
| கோண உந்தக் குவாண்டம் எண் | l | துணைக் கூடு / ஆர்பிட்டல் வடிவம் |
| காந்த குவாண்டம் எண் | m | ஆர்பிட்டல் அமைவிடம் |
| சுழற்சி குவாண்டம் எண் | s | எலக்ட்ரான்களின் சுழற்சி |
நீங்கள் ஒரு கட்டிடத்தின் இடத்தைக் குறிக்கும் போது, எப்படி பட்டியலிடுவீர்கள்? அது எந்த நாட்டிலுள்ளது, எந்த மாநிலத்திலுள்ளது, எந்த நகரத்திலுள்ளது, அதன் இருப்பிடம் மற்றும் தெரு என்ன, இறுதியாக கதவு எண் என்ன எனக் கேட்பீர்கள். அதைப் போலவே ஒரு அணுவிலுள்ள எலக்ட்ரான்களின் அமைவிடத்தையும் நாம் குறிக்கலாம்.
அணுவின் உள்ளிருக்கும் அணு ஆர்ப்பிட்டல் மற்றும் எலக்ட்ரான்களின் வடிவமைப்பு மற்றும் வேறுபாட்டைக் குறிக்கும் எண்கள் “குவாண்டம் எண்கள்” எனப்படும்.