அணு அமைப்பு Notes 8th Science Lesson 12 Notes in Tamil
அணு அமைப்பு
அறிமுகம்
- நம்மைச் சுற்றியுள்ள பருப்பொருள்கள் அனைத்தும் தனிமங்களால் ஆனவை. இதுவரை மொத்தம் 118 தனிமங்கள் கண்டறியப்பட்டுள்ளன. அவற்றுள் 92 தனிமங்கள் இயற்கையில் கிடைக்கக் கூடியவை. மீதமுள்ள தனிமங்கள் ஆய்வகத்தில் தயாரிக்கப்படுகின்றன.
- தாமிரம், இரும்பு, தங்கம் மற்றும் வெள்ளி ஆகிய தனிமங்கள் இயற்கையில் கிடைக்கின்றன. ஆனால் டெக்னீசியம், புரோமோதியம், நெப்டியூனியம் மற்றும் புளுட்டோனியம் போன்ற தனிமங்கள் ஆய்வகங்களில் தயாரிக்கப்படுகின்றன. அனைத்துத் தனிமங்களும் ஒரே மாதிரியான மிகச் சிறிய துகள்களால் ஆனவை.
- உதாரணமாக தங்கம் எனும் தனிமம் ஒரேவித அணுக்களால் ஆனது. இவ்வணுக்களே தங்கத்தின் பண்புகளுக்குக் காரணமாக அமைகின்றன. அணு என்பது அட்டாமஸ் (Atomas) எனும் கிரேக்கச் சொல்லிலிருந்து உருவாக்கப்பட்டது. டாமஸ் (Tomas) என்பது உடைக்கக் கூடிய மிகச் சிறிய துகள் என்றும் அட்டாமஸ் (Atomas) என்பது உடைக்க இயலாத மிகச் சிறிய துகள் என்றும் பொருள்படும். இதே கருத்தை கிரேக்கத் தத்துவமேதையான டெமாக்ரடீஸ் என்பவரும் கூறியுள்ளார்.
- மேலும் அதற்கு முன்னரே நமது பெண்பாற்புலவர் அவ்வையார் திருக்குறளின் பெருமையைப் பற்றிக் கூறும் போது “அணுவைத் துளைத்து ஏழ் கடலைப்புகட்டிக் குறுகத் தரித்த குறள்” என அணுவைப் பற்றிய தனது கருத்தைக் கூறியுள்ளார். ஆனால், அவற்றிற்கு அறிவியல் ஆதாரம் எதுவும் இல்லை.
- ஜான் டால்டன் என்பவரே முதன் முதலில் அணுவைப் பற்றிய அறிவியல் பூர்வமான கொள்கையை வெளியிட்டார். அவரைத் தொடர்ந்து ஜே.ஜே. தாம்சன் மற்றும் ரூதர்போர்டு ஆகியோரும் தங்களது அணுக் கொள்கைகளை வெளியிட்டனர்.
- இப்பாடப்பகுதியில் வெவ்வேறு காலகட்டத்தில் கூறப்பட்ட அணுக் கொள்கைகள் பற்றியும், இணைதிறன், மூலக்கூறு வாய்ப்பாடு, வேதிச் சேர்மங்களுக்குப் பெயரிடும் முறை மற்றும் வேதிச் சமன்பாடுகளைச் சமன் செய்யும்முறை ஆகியவற்றைப் பற்றியும் காண்போம்.
டால்டனின் அணுக்கொள்கை
டால்டன் 1808-ஆம் ஆண்டு தம்மால் மேற்கொள்ளப்பட்ட ஆய்வு முடிவுகளின் அடிப்படையில் தமது அணுக் கொள்கையை வெளியிட்டார். அவருடைய அணுக் கொள்கையின் முக்கியக் கருதுகோள்கள் பின்வருமாறு:
- பொருள்கள் அனைத்தும் அணு எனப்படும் மிகச்சிறிய துகள்களால் ஆனவை (கிரேக்க தத்துவமேதை டெமாக்ரடீஸ் பிளக்க இயலாத மிகச்சிறிய துகள்களை அணு என்றே அழைத்தார்).
- ஒரே தனிமத்தின் அணுக்கள் அனைத்துப் பண்புகளிலும் ஒத்திருக்கின்றன (அளவு, வடிவம், நிறை மற்றும் பண்புகள்).
- வெவ்வேறு தனிமங்களின் அணுக்கள் அவற்றின் வடிவம், நிறை மற்றும் பண்புகளில் வேறுபட்டிருக்கின்றன.
- அணுவை ஆக்கவோ அழிக்கவோ முடியாது. அதாவது அணுவானது அழிக்கமுடியாத துகள்.
- வெவ்வேறு தனிமங்களின் அணுக்கள் ஒரு குறிப்பிட்ட நிறை விகிதத்தில் ஒன்றிணைந்து மூலக்கூறுகள் மற்றும் சேர்மங்களை உருவாக்குகின்றன.
- அணு என்பது வேதிவினையில் ஈடுபடக்கூடிய மிகச்சிறிய துகள்.
டால்டன் அணுக்கொள்கையின் சிறப்புகள்
- டால்டனின் அணுக் கொள்கை பெரும்பாலான திரவங்கள் மற்றும் வாயுக்களின் பண்புகளை விவரிக்கின்றது.
- வேதிச் சேர்க்கை விதி மற்றும் பொருண்மை அழிவின்மை விதியினை இது விளக்குகிறது.
- தனிமங்களின் மூலக்கூறுகள் மற்றும் சேர்மங்களின் மூலக்கூறுகளுக்கு இடையேயான வேறுபாடுகளை இது எடுத்துரைக்கிறது.
டால்டன் அணுக்கொள்கையின் வரம்புகள்
- அணு என்பது பிளக்க முடியாத மிகச் சிறிய துகள் என்பது தவறு.
- ஒரே தனிமத்தின் அணுக்கள் வெவ்வேறு அணு நிறைகளைப் பெற்றுள்ளன (ஐசோடோப்புகள்).
- வெவ்வேறு தனிமங்களின் அணுக்கள் ஒரே அணுநிறையைப் பெற்றுள்ளன (ஐசோபார்கள்).
- ஒரே மாதிரியான அணுக்களால் உருவாகக்கூடிய பொருள்கள் வெவ்வேறு பண்புகளைப் பெற்றிருக்கின்றன. உதாரணமாக நிலக்கரி, கிராஃபைட், வைரம் ஆகிய மூன்றும் கார்பன் அணுக்களால் ஆனவை. ஆனால் அவற்றின் பண்புகள் வேறுபடுகின்றன.

ஜான் டால்சன் ஒரு ஏழ்மையான நெசவுக் குடும்பத்தில் பிறந்தவர். அவர் தனது 12ஆவது வயதில் ஒரு கிராமத்துப் பள்ளியில் ஆசிரியராகப் பணியேற்றார். ஏழு ஆண்டுகளுக்குப் பிறகு அவர் அப்பள்ளியின் தலைமை ஆசிரியரானார். பின் 1973ல் அவர் மான்செஸ்டரில் உள்ள ஒரு கல்லூரியில் இயற்பியல், வேதியியல் மற்றும் கணிதம் ஆகிய பாடங்களைக் கற்பிக்கும் பேராசிரியராகப் பணிபுரிந்தார். அவரது இறுதிக்காலம் வரை வளிமண்டல அழுத்தம் மற்றும் மழையளவினைப் பதிவு செய்வதைத் தனது வழக்கமாகக் கொண்டிருந்தார். அவர் ஒரு சிறந்த வானியல் ஆராய்ச்சியாளராக இருந்தார்.
அடிப்படைத் துகள்கள்
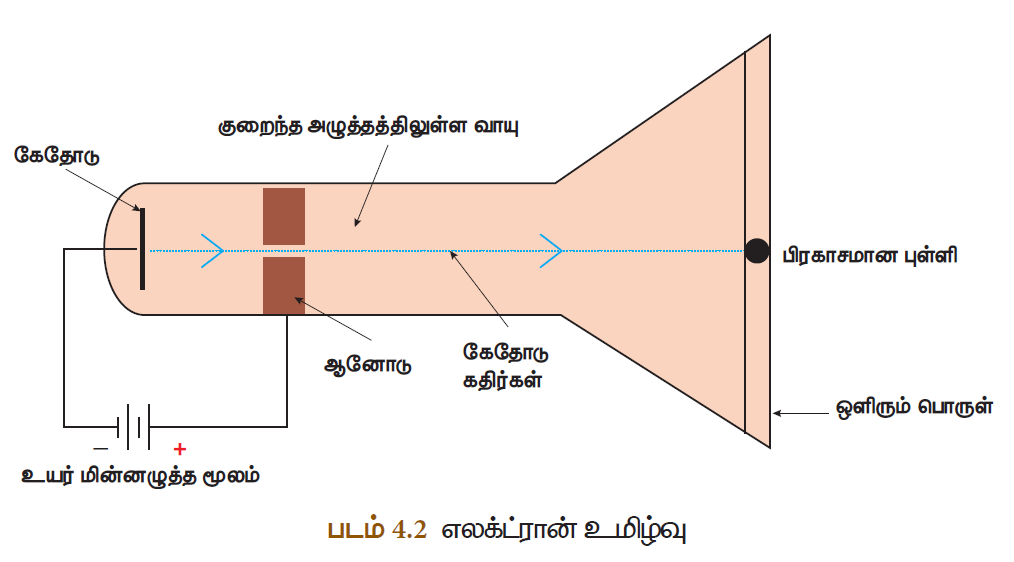
- 1878ஆம் ஆண்டில் சர் வில்லியம் குரூக் என்பவர் மின்னிறக்கக் குழாயைக் கொண்டு சோதனை மேற்கொள்ளும்போது இரு உலோக மின்வாய்களுக்கு இடைப்பட்ட பகுதியில் கண்ணிற்குப் புலப்படும் வகையில் ஒளிக்கற்றை பாய்வதைக் கண்டார். இக்கதிர்கள் குரூக் கதிர்கள் அல்லது கேதோடு கதிர்கள் எனப்பட்டன.
- இச்சோதனையில் பயன்படுத்தப்படும் மின்னிறக்கக் குழாய் ‘குரூக்குழாய்’ அல்லது ‘கேதோடு கதிர் குழாய்’ எனப்படுகிறது. கேதோடு கதிர் குழாய் என்பது வாயு நிரப்பப்பட்ட , இருபுறமும் மூடப்பட்ட ஒரு நீண்ட கண்ணாடிக் குழாயாகும்.
- இதன் இரு முனைகளிலும் இரு உலோகத் தகடுகள் (மின்வாய்கள்) அதிக மின்னழுத்த வேறுபாடு தரும் மின்கலனுடன் இணைக்கப்பட்டுள்ளன. மின்கலனின் எதிர்மின் முனையுடன் இணைக்கப்படும் மின்வாய் கேதோடு (எதிர்மின்வாய்) எனவும், நேர்மின் முனையுடன் இணைக்கப்படும் மின்வாய் ஆனோடு (நேர்மின்வாய்) எனவும் அழைக்கப்படுகிறது.
- மேலும் அதன் பக்கக்குழாயானது இறைப்பானுடன் (Pump) இணைக்கப்பட்டுள்ளது. மின்னிறக்கக் குழாயினுள் உள்ள அழுத்தத்தைக் குறைக்க இறைப்பான் பயன்படுகிறது.
- மின்சாரம் காற்றின் வழியே பாயும்போது வாயு மூலக்கூறுகளிலிருந்து எலக்ட்ரான்கள் வெளியேறுவதால் அயனிகள் உருவாகின்றன. இதுவே மின்னிறக்கம் எனப்படும்.
எலக்ட்ரான் கண்டுபிடிப்பு
- 10,000 வோல்ட் அல்லது அதற்கு மேற்பட்ட உயர் அழுத்த மின்சாரத்தை வளிமண்டல அழுத்தத்தில் வாயு அல்லது காற்றினால் நிரப்பப்பட்ட மின்னிறக்கக் குழாயினுள் செலுத்தும் போது காற்றின் வழியே எந்தவித மின்சாரமும் பாய்வதில்லை.
- ஆனால் மின்னிறக்கக்குழாயில் 0.001மி.மீ அளவிலான மிகக்குறைந்த வளிமண்டல அழுத்தத்தில் நிரப்பப்பட்டிருக்கும் வாயுவின் வழியே 10,000 வோல்ட் அளவிலான உயர் அழுத்த மின்சாரத்தைச் செலுத்தும்போது குழாயின் மறுமுனையில் ஒளிர்தல் ஏற்படுவதைக் காணலாம்.
- இக்கதிர்கள் எதிர்மின்வாயிலிருந்து வெளிவருவதால் கேதோடு கதிர்கள் (எதிர்மின்வாய்க் கதிர்கள்) எனப்பட்டன. பின்னர் இவை எலக்ட்ரான்கள் எனப் பெயரிடப்பட்டன.
- காற்று மின்கடத்தாப் பொருளாக இருப்பது இயற்கையின் வரமாகும். ஒருவேளை காற்று ஒரு சிறந்த மின் கடத்தியாக இருக்குமானால், எதிர்பாராத விபத்தினால் உருவாகும் சிறு மின்பொறிகூட மிகப்பெரிய ஆபத்தினை விளைவிக்கக்கூடும்.
கேதோடு கதிர்களின் பண்புகள்
- கேதோடு கதிர்கள் எதிர்மின் முனையிலிருந்து நேர்மின் முனையை நோக்கி நேர்கோட்டில் பயணிக்கின்றன.
- கேதோடு கதிர்கள் துகள்களால் உருவாக்கப்பட்டவை. எனவே இவை நிறை மற்றும் இயக்க ஆற்றலைப் பெற்றிருக்கின்றன.
- கேதோடு கதிர்கள் எதிர்மின்சுமையைப் பெற்றுள்ளதால், அவை மின்புலம் மற்றும் காந்தப்புலத்தால் விலக்கமடைகின்றன.
- கேதோடு கதிர்களின் பண்புகள் மின்னிறக்கக் குழாயில் நிரப்பப்படும் வாயுக்களைப் பொறுத்து மாறுபடுவதில்லை.
- திலைக்காட்சிப் பெட்டியில் கேதோடு கதிர்கள் காந்தப் புலத்தால் விலகலடைந்து அதன் முகப்புத்திரையில் வீழ்த்தப்படுகின்றன. இவை ஒளிப்படத்தை உருவாக்குகின்றன.
புரோட்டான் கண்டுபிடிப்பு
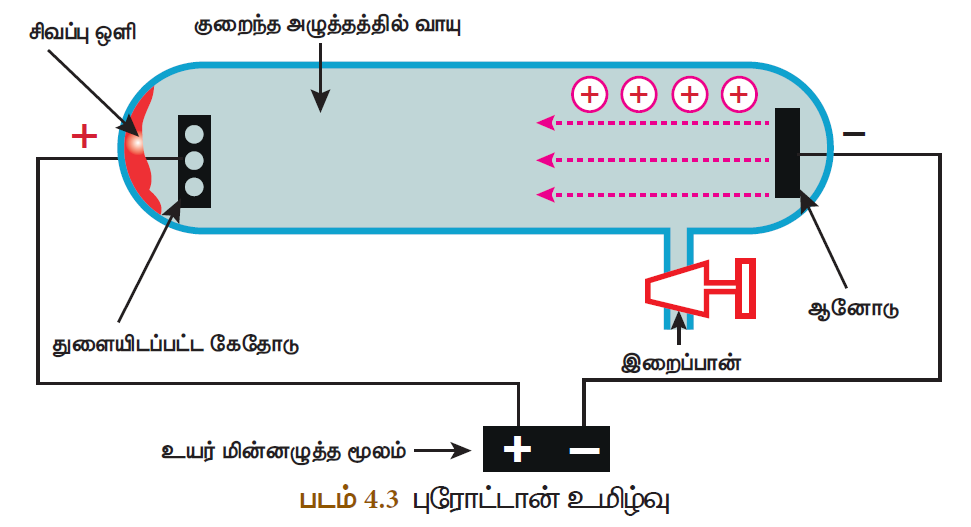
- அணுவானது நடுநிலைத் தன்மை உடையது. அணுவில் எதிர் மின்னூட்டம் கொண்ட துகள்கள் இருப்பதால் அவற்றைச் சமன்செய்ய அதே அளவிலான நேர்மின்னூட்டம் கொண்ட துகள்கள் இருக்க வேண்டும் என கோல்ட்ஸ்டீன் கருதினார்.
- கோல்ஸ்டீன், துளையிடப்பட்ட எதிர்மின் வாயைப் பயன்படுத்தி எதிர்மின்வாய்க்கதிர் சோதனையை மீண்டும் நடத்தினார். குறைந்த அழுத்தத்தில் உள்ள வாயுவினுள் உயர் மின் அழுத்தத்தைச் செலுத்தும்போது எதிர் மின்வாயின் பின்புறம் மங்கிய சிவப்பு நிற ஒளியானது தோன்றுவதைக் கண்டார்.
- இக்கதிர்கள் நேர்மின்வாயிலிருந்து உருவாவதால் அவை நேர்மின்வாய்க் கதிர்கள் அல்லது ஆனோடு கதிர்கள் அல்லது கால்வாய் கதிர்கள் என அழைக்கப்பட்டன. நேர்மின்வாய்க் கதிர்கள் நேர்மின்னூட்டம் கோண்ட துகள்களால் ஆனவை.
- கண்ணிற்குப் புலப்படாத கதிர்கள் துத்தநாக சல்பைடு பூசப்பட்ட திரையில் விழும் போது கண்ணிற்குப் புலப்படும் ஒளியை உமிழ்கின்றன. இப்பொருள்கள் ஒளிரும் பொருள்கள் எனப்படுகின்றன.
ஆனோடு கதிர்களின் பண்புகள்
- ஆனோடு கதிர்கள் நேர் கோட்டில் செல்கின்றன.
- ஆனோடு கதிர்கள் துகள்களால் ஆனவை.
- ஆனோடு கதிர்கள் மின்புலம் மற்றும் காந்தப் புலத்தால் விலக்கமடைகின்றன. அவை நேர் மின்னூட்டம் கொண்டுள்ளதால் எதிர் மின்வாயை நோக்கி விலக்கமடைகின்றன.
- நேர் மின்வாய்க் கதிர்களின் பண்புகள் மின்னிறக்கக் குழாயினுள் இருக்கும் வாயுவின் தன்மையைச் சார்ந்து அமையும்.
- துகளின் நிறை மின்னிறக்கக் குழாயிலுள்ள வாயுவின் அணு நிறைக்குச் சமமாக இருக்கும்.
- ஹைட்ரஜன் வாயுவை மின்னிறக்கக் குழாயினுள் எடுத்துக்கொள்ளும் போது பெறப்படும் நேர்மின்துகள்கள் புரோட்டான்கள் எனப்படுகின்றன. ஒரு ஹைட்ரஜன் அணுவிலிருந்து ஒரு எலக்ட்ரானை நீக்கும்போது ஒரு புரோட்டான் கிடைக்கிறது. எனவே புரோட்டான் என்பதை ஹைட்ரஜன் அயனி (H+) எனவும் அழைக்கலாம்.
H H+ + e+
நியூட்ரான் கண்டுபிடிப்பு
ஜே.ஜே.தாம்சனின் காலத்தில் இரண்டு அடிப்படைத்துகள்கள் மட்டுமே கண்டுபிடிக்கப்பட்டிருந்தன (புரோட்டான் மற்றும் எலக்ட்ரான்). 1932ஆம் ஆண்டு ஜேம்ஸ் சாட்விக் மற்றொரு அடிப்படைத்துகளான நியூட்ரானைக் கண்டுபிடித்தார். அணுவில் நியூட்ரான்களின் அமைவிடத்தைப் பற்றிய தெளிவான விளக்கத்தை ரூதர்போர்டு தனது அணுக்கொள்கையில் குறிப்பிட்டுள்ளார். ரூதர்போர்டு அணுமாதிரியைப் பற்றி விரிவாக உங்களது மேல்வகுப்புகளில் அறிந்து கொள்ளலாம்.
நியூட்ரானின் பண்புகள்
- நியூட்ரான் மின்சுமையற்ற துகள். எனவே, இது மின்நடுநிலைத்தன்மை வாய்ந்தது.
- இதன் நிறை புரோட்டானின் நிறைக்குச் சமமானது. நியூட்ரானின் நிறை 1.6 X 10-24 கி.
அடிப்படைத் துகள்களின் பண்புகள்
| துகள் | நிறை | மின்சுமை |
| எலக்ட்ரான் (e) | 9.1 X 10-28 கிராம் | -1 |
| புரோட்டான் (p) | 1.6 X 10-24 கிராம் | +1 |
| நியூட்ரான் (n) | 1.6 X 10-24 கிராம் | 0 |
தாம்சனின் அணுமாதிரி
- எலக்ட்ரான் கண்டுபிடிப்புக்குப் பிறகு ஜே.ஜே. தாம்சம் என்ற இங்கிலாந்து நாட்டு அறிவியல் அறிஞர் 1904ஆம் ஆண்டு தனது அணுக்கொள்கையை வெளியிட்டார்.
- அணுவின் வடிவமானது , 10-10 மீ ஆரமுடைய கோளத்தை ஒத்துள்ளது என்று தாம்சன் கருதினார். எதிர்மின் சுமையுடைய துகள்கள் நேர்மின் சுமையுடைய கோளத்தில் புதைந்து காணப்படுகின்றன. எனவேதான் ஒரு அணுவானது நடுநிலைத்தன்மையுடன் உள்ளது என்றும் அவர் கருதினார்.
- தாம்சனின் மாதிரியானது பிளம் புட்டிங் மாதிரி (Plum Pudding Model) அல்லது தர்பூசணிப்பழ மாதிரி (Water Melon Model) எனவும் அழைக்கப்படுகிறது. தர்பூசணிப் பழத்திலுள்ள விதைகள் எதிர்மின்சுமையுடைய எலக்ட்ரான்களாகவும் அதிலுள்ள சிவப்பு நிற சதைப்பகுதியானது நேர்மின் சுமையுடைய புரோட்டான்களாகவும் கருதப்படுகிண்றன.
- மேலும் அணுவின் நிறையானது அணு முழுவதும் சமமாகப் பரவுயிருப்பதாகக் கருதப்பட்டது.
தாம்சன் அணு மாதிரியின் வரம்புகள்
தாம்சன் அணு மாதிரியானது அணுவின் நடுநிலைத் தன்மையை விளக்குகிறது. ஆனால் கீழ்க்கண்டவற்றிற்கான சரியான விளக்கங்களை அதனால் தர இயலவில்லை.
- நேர்மின்னூட்டம் பெற்ற கோளம் எவ்வாறு எதிர்மின்னூட்டம் பெற்ற எலக்ட்ரான்களை ஈர்த்து மின் நடுநிலைத்தன்மை அடைவதிலிருந்து தன்னைப் பாதுகாத்துக் கொள்கிறது என்பதை விளக்க முடியவில்லை.
- இந்த அணு மாதிரியானது புரோட்டான்கள் மற்றும் எலக்ட்ரான்களைப் பற்றி மட்டும் விவரிக்கிறது. நியூட்ரான்களைப் பற்றிக் கூறவில்லை.
இணைதிறன்
- இணைதிறனைப் பற்றி முழுமையாகத் தெரிந்து கொள்வதற்கு ரூதர்போர்டு மற்றும் நீல்ஸ்போரின் அணு மாதிரியைப் பற்றி சிறிது அறிந்து கொள்ள வேண்டியது அவசியம். ரூதர்போர்டின் கூற்றுப்படி அணுவானது புரோட்டான், எலக்ட்ரான், நியூட்ரான் போன்ற அணுக்கூறுகளைப் பெற்றுள்ளது. அவற்றுள் புரோட்டான்கள் மற்றும் நியூட்ரான்கள் அணுவின் மத்தியில் உள்ள உட்கருவில் காணப்படுகின்றன.
- எலக்ட்ரான்கள் உட்கருவை வட்டப்பாதையில் சுற்றிவருகின்றன. இந்த வட்டப்பாதை ‘ஆர்பிட்’ அல்லது ‘எலக்ட்ரான் கூடு’ எனப்படுகிறது.
- ஒரு அணுவானது ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான் கூட்டினைக் கொண்டுள்ளது. அவற்றின் கடைசி எலக்ட்ரான் கூட்டில் உள்ள எலக்ட்ரான்களே ‘இணைதிறன் எலக்ட்ரான்கள்’ எனப்படுகின்றன. இக்கூடு ‘இணைதிறன் கூடு’ எனப்படுகிறது.
- எலக்ட்ரான் கூடுகளில் உள்ள எலக்ட்ரான்களின் ஒருங்கமைவு ‘எலக்ட்ரான் அமைப்பு’ எனப்படும். அனைத்துத் தனிமகளின் அணுக்களும் இயல்பாகவே நிலையான எலக்ட்ரான் அமைப்பைப்பெற விரும்புகின்றன.
- அதாவது, அனைத்து அணுக்களும் நிலைத்த எலக்ட்ரான் அமைப்பைப் பெற தங்களது இணைதிறன் கூட்டில் இரண்டு (அ) எட்டு எலக்ட்ரான்களைப் பெற்றிருக்க வேண்டும். இந்த எலக்ட்ரான் அமைப்பைப் பெற்றுள்ள மந்த வாயுக்கள் அதிக நிலைப்புத் தன்மை பெற்றவை.
- உதாரணமாக ஹீலியம் தனது இணைதிறன் கூட்டில் இரண்டு எல்கட்ரான்களையும், நியான் தனது இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான்களையும் பெற்றிருப்பதால் அவை எந்த வேதிவினையிலும் ஈடுபடுவதில்லை. மேலும், அவை அதிக நிலைப்புத்தன்மை கொண்டுள்ளன.
- ஒரு அணுவின் இணைதிறன் எலக்ட்ரான்களே வேதிவினையில் பங்குபெறுவதால், அவையே அவ்வணுவின் வேதிப் பண்புகளைத் தீர்மானிக்கின்றன.
- வெவ்வேறு அணுக்கள் வெவ்வேறு இணையும் திறனைப் பெற்றிருப்பதால் அவை ஒரு குறிப்பிட்ட விகிதத்தில் இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன.
- ஒரு அணு வேறொரு அணுவுடன் இணையக்கூடிய திறனே அவ்வணுவின் இணைதிறன் எனப்படும். “ஒரு வேதிவினையின்போது நிலைப்புத் தன்மையை அடைவதற்காக அந்த அணுவால் ஏற்றுக்கொள்ளப்பட்ட அல்லது இழக்கப்பட்ட அல்லது பகிர்ந்து கொள்ளப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கையே அந்த அணுவின் இணைதிறன்” ஆகும்.
இணைதிறனின் வகைகள்
- நாம் முன்னரே கூறியவாறு அணுக்கள் நிலைத்த தன்மையைப் பெறுவதற்காக எலக்ட்ரான்களை இழக்கவோ அல்லது ஏற்கவோ செய்கின்றன. ஒரு அணுவின் இணையும் திறனை தெளிவாகப் புரிந்து கொள்வதற்காக அந்த அணு எலக்ட்ரான்களை இழக்கிறதா அல்லது ஏற்கிறதா என்பதை அடிப்படையாகக் கொண்டு இணைதிறனானது இரண்டு முறைகளில் விளக்கப்படுகிறது.
- பெரும்பாலும் உலோக அணுக்கள் அவற்றின் இணைதிறன் கூட்டில் 1 முதல் 3 எலக்ட்ரான்களைப் பெற்றுள்ளன. வேதிவினையின்போது இவ்வணுக்கள் நிலைத்த தன்மையைப் பெறுவதற்காக ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழந்து நேர்மின்சுமையைப் பெறுகிண்ரன
- எனவே, இவ்வணுக்கள் ‘நேர்மறை இணைதிறன்’ (Positive Valency) கொண்டவை எனப்படுகின்றன. உதாரணமாக, சோடியம் அணுவானது வேதிவினையின்போது தனது இணைதிறன் கூட்டில் உள்ள ஒரு எலக்ட்ரானை இழந்து நேர்மின்சுமையைப் பெறுகின்றது. எனவே சோடியம் நேர்மறை இணைதிறனைக் கொண்டதாகும்.
- அலோக அணுக்கள் அவற்றின் இணைதிறன் கூட்டில் 4 முதல் 7 எலக்ட்ரான்களைப் பெற்றுள்ளன. வேதிவினையின்போது இவ்வணுக்கள் நிலைத்த தன்மையைப் பெறுவதற்காக ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை ஏற்று எதிர்மின் சுமையைப் பெறுகின்றன. எனவே இவ்வணுக்கள் ‘எதிர்மறை இணைதிறன்’ (Negative Valency) கொண்டவை எனப்படுகின்றன.
- உதாரணமாக, குளோரின் அணுவானது வேதிவினையின்போது ஒரு எலக்ட்ரானை ஏற்று எதிர்மின்சுமையைப் பெறுகின்றது. எனவே குளோரின் எதிர்மறை இணைதிறனைக் கொண்டதாகும்.
அணுக்களைப் பொறுத்து இணைதிறனைக் கணக்கிடுதல்
பொதுவாக, அணுக்களின் இணைதிறனானது ஹைட்ரஜன், ஆக்சிஜன் மற்றும் குளோரின் ஆகிய அணுக்களின் இணைதிறனைப் பொறுத்துக் கணக்கிடப்படுகிறது.
அ. ஹைட்ரஜனைப் பொறுத்து இணைதிறனைக் கணக்கிடுதல்
- ஹைட்ரஜன் தனது இணைதிறன் கூட்டில் உள்ள ஒரு எலக்ட்ரானை இழப்பதால் அதன் இணைதிறன் ஒன்று ஆகும். இதனை அடிப்படையாக எடுத்துக்கொண்டு பிற தனிமங்களின் இணைதிறன் கணக்கிடப்படுகிறது.
- ஒரு தனிமத்தின் ஒரு அணுவுடன் இணையக் கூடிய ஹைட்ரஜன் அணுக்களின் எண்ணிக்கையே அத்தனிமத்தின் இணைதிறன் எனப்படும்.
- உதாரணமாக ஹைட்ரஜன் குளோரைடு மூலக்கூறில் ஒரு ஹைட்ரஜன் அணு ஒரு குளோரின் அணுவுடன் இணைகிறது. எனவே குளோரினின் இணைதிறன்
1. அதேபோல் நீர் மூலக்கூறில் இரண்டு ஹைட்ரஜன் அணுக்கள் ஒரு ஆக்சிஜன் அணுவுடன் இணைகின்றன. எனவே ஆக்சிஜனின் இணைதிறன் 2. ஆனால் சில தனிமங்கள் ஹைட்ரஜனுடன் விணைபுரிவதில்லை. எனவே குளோரின் மற்றும் ஆக்சிஜனைப் பொறுத்து அவற்றின் இணை திறன்களைக் கணக்கிடலாம். ஏனெனில் பெரும்பாலான தனிமங்கள் குளோரின் மற்றும் ஆக்சிஜனுடன் வினைபுரிகின்றன.
அணுக்களின் இணைதிறன்
| மூலக்கூறு | தனிமம் | இணைதிறன் |
| ஹைட்ரஜன் குளோரைடு (HCl) | குளோரின் | 1 |
| நீர் (H2O) | ஆக்சிஜன் | 2 |
| அம்மோனியா (NH3) | நைட்ரஜன் | 3 |
| மீத்தேன் (CH4) | கார்பன் | 4 |
ஆ. குளோரினைப் பொறுத்து இணைதிறனைக் கணக்கிடுதல்
குளோரின் இணைதிறன் ஒன்று என்பதால், ஒரு தனிமத்தின் ஒரு அணுவுடன் இணௌயக் கூடிய குளோரின் அணுக்களின் எண்ணிக்கையே அத்தனிமத்தின் இணை திறன் எனப்படுகிறது. சோடியம் குளோரைடு (NaCl) மூலக்கூறில், ஒரு குளோரின் அணு ஒரு சோடியம் அணுவுடன் இணைகிறது. எனவே, சோடியத்தின் இணைதிறன் ஒன்று. மெக்னீசியம் குளோரைடு (MgCl2) மூலக்கூறில் இரண்டு குளோரின் அணுக்கள் ஒரு மெக்னீசியம் அணுவுடன் இணைவதால் மெக்னீசியத்தின் இணைதிறன் 2.
இ. ஆக்சிஜனைப் பொறுத்து இணைதிறனைக் கணக்கிடுதல்
ஆக்சிஜனின் இணைதிறன் இரண்டு என்பதால், ஒரு தனிமத்தின் ஒரு அணுவுடன் இணையக்கூடிய ஆக்சிஜன் அணுக்களின் எண்ணிக்கையினை இரண்டால் பெருக்கினால் கிடைப்பதே அத்தனிமத்தின் இணைதிறன் ஆகும். உதாரணமாக மெக்னீசியம் ஆக்சைடில் (MgO) ஒரு மெக்னீசியம் அணு ஒரு ஆக்சிஜன் அணுவுடன் இணைவதால் மெக்னீசியத்தின் இணைதிறன் 2.
மாறும் இணைதிறன்
- ஒருசில தனிமங்களின் அணுக்கள் ஒன்றிணைந்து ஒன்றுக்கு மேற்பட்ட சேர்மங்களை உருவாக்கும்போது, அவற்றின் இணையக்கூடிய திறன்கள் ஒரே மாதிரியாக இருப்பதில்லை. அத்தகைய சேர்மங்களின் தனிமங்கள் மாறக்கூடிய இணைதிறன்களைப் பெற்றுள்ளன.
- உதாரணமாக தாமிரம், ஆக்சிஜனுடன் வினைபுரிந்து குப்ரஸ் ஆக்ஸைடு (Cu2O) மற்றும் குப்ரிக் ஆக்ஸைடு (CuO) ஆகிய இரண்டு சேர்மங்களை உருவாக்குகிறது. இதில் குப்ரஸ் ஆக்சைடில் (CuO) தாமிரத்தின் இணைதிறன் இரண்டு ஆகும்.
- இவற்றுள் குறைந்த இணைதிறன் கொண்ட உலோகச் சேர்மத்திற்குப் பெயரிடும்போது உலோகத்தின் பெயருடன் ‘அஸ்’ (ous) என்ற பின்னோட்டைச் சேர்க்கவேண்டும்.
- அதுபோலவே, அதிக இணைதிறன் கொண்ட உலோகச் சேர்மத்திற்குப் பெயரிடும்போது உலோகத்தின் பெயருடன் ‘இக்’ (ic) என்ற பின்னொட்டைச் சேர்க்கவேண்டும். சில நேரங்களில் உரோம எண்களை (I, II, III, IV, ……) உலோகத்தின் பெயருடன் சேர்த்தும் எழுதலாம்.
உலோகங்களின் மாறும் இணைதிறன்
| தனிமம் | நேர் அயனி | பெயர் |
| தாமிரம் | Cu+ | குப்ரஸ் (அ) காப்பர் (I) |
| Cu2+ | குப்ரிக் (அ) காப்பர் (II) | |
| இரும்பு | Fe2+ | பெர்ரஸ் (அ) இரும்பு (II) |
| Fe3+ | பெர்ரிக் (அ) இரும்பு (III) | |
| மெர்குரி (பாதரசம்) | Hg+ | மெர்குரஸ் (அ) மெர்குரி (I) |
| Hg2+ | மெர்குரிக் (அ) மெர்குரி (II) | |
| டின் | Sn2+ | ஸ்டேன்னஸ் (அ) டின் (II) |
| Sn4+ | ஸ்டேன்னிக் (அ) டின் (IV) |
அயனிகள்
- ஒரு அணுவில் எலக்ட்ரான்களும், புரோட்டான்களும் சம எண்ணிக்கையில் இருப்பதால், அணுவானது நடுநிலைத்தன்மை வாய்ந்ததாக உள்ளது. ஆனால் , வினையில் ஈடுபடும்போது நிலைத்த தன்மையைப் பெறுவதற்காக அணுக்கள் ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழக்கவோ அல்லது ஏற்கவோ செய்கின்றன.
- ஒரு அணு எலக்ட்ரானை ஏற்பதால், எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கிறது. எனவே, அவ்வணு எதிர்மின்சுமை பெறுகிறது. எலக்ட்ரானை இழப்பதால், ஒரு அணுவில் புரோட்டான்களின் எண்ணிக்கை அதிகரிக்கிறது. எனவே அவ்வணு நேர்மின்சுமை பெறுகிறது. இத்தகைய நேர்மின்சுமை அல்லது எதிர்மின்சுமை பெற்ற அணுக்களே அயனிகள் எனப்படுகின்றன.
- இவ்வாறு இழக்கப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கையானது, நேர்குறியுடன் (+) சேர்த்து, அத்தனிமத்தின் குறியீட்டின் மேற்புறத்தில் குறிக்கப்படும். அதுபோலவே ஏற்கப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கையானது, எதிர்க்குறியுன் (-) சேர்த்து, அந்தத் தனிமத்தின் குறியீட்டின் மேற்புறத்தில் குறிக்கப்படும்.
- நில நேரங்களில் ஒன்றிற்கு மேற்பட்ட தனிமங்கள் ஒன்றாக இணைந்து எலக்ட்ரான்களை இழந்தோ அல்லது ஏற்றோ முறையே நேர்மின்சுமையுடைய அல்லது எதிர்மின்சுமையுடைய அயனித்தொகுப்பு உருபுகளாக மாறுகின்றன.
அயனிகளின் வகைகள்
அயனிகள் இருவகையாகப் பிரிக்கப்படுகின்றன. அவை நேரயனி மற்றும் எதிரயனி ஆகும்.
நேரயனி
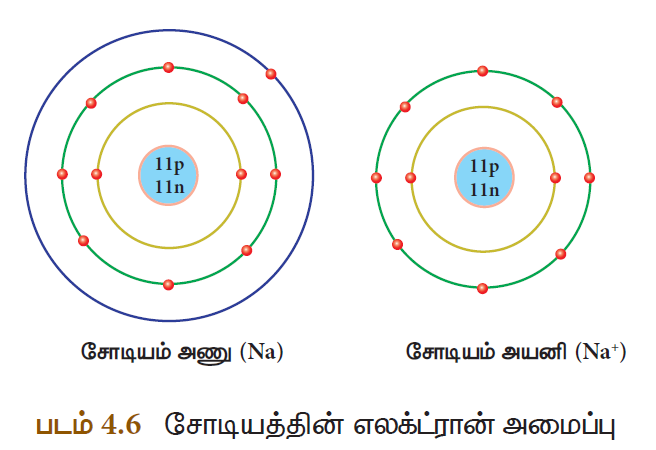
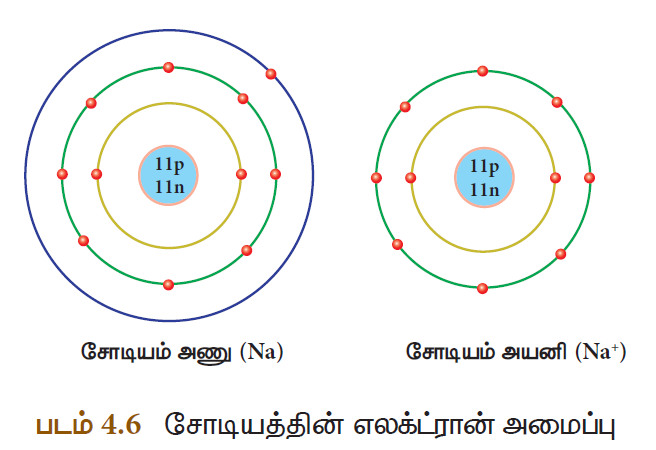
வேதிவினையின்போது ஒரு அணுவானது ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழப்பதால் நேர் மின்சுமையைப் பெறுகிறது. இவையே நேரயனி அல்லது நேரயனித் தொகுப்பு எனப்படும். உதாரணமாக, சோடியம் அணுவானது நிலைத்த தன்மையைப் பெறுவதற்காக ஒரு எலக்ட்ரானை இழந்து நேர் மின்சுமை கொண்ட சோடியம் நேரயனியாக மாறுகிறது. சோடியம் நேரயனியானது Na+ எனக் குறிப்பிடப்படுகிறது.
எதிரயனி
வேதிவினையின்போது ஒரு அணுவானது ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை ஏற்பதால் எதிர் மின்சுமையைப் பெறுகிறது. இவையே எதிரயனி அல்லது எதிரயனித் தொகுப்பு எனப்படும். உதாரணமாக குளோரின் அணுவானது நிலைத்த தன்மையைப் பெறுவதற்காக ஒரு எலக்ட்ரானை ஏற்று எதிர்மின்சுமை கொண்ட குளோரின் எதிரயனியாக மாறுகிறது. குளோரின் எதிரயனியானது Cl– எனக் குறிப்பிடப்படுகிறது.
அயனிகளின் வெவ்வேறு இணைதிறன்கள்
ஒன்று அல்லது அதற்கு மேற்பட்ட தனிமங்கள் தனியாகவோ அல்லது குழுவாகவோ எலக்ட்ரான்களை இழப்பதாலோ அல்லது ஏற்பதாலோ உருவாகக்கூடிய மின்சுமை 1, 2, 3 மற்றும் 4 என இருந்தால், அவை முறையே ஒற்றை மின்சுமை, இரட்டை மின்சுமை , மும்மை மின்சுமை மற்றும் நான்கு மின்சுமை பெற்ற அயனிகள் அல்லது அயனித் தொகுப்புகள் எனக் குறிப்பிடப்படுகின்றன.
எதிரயனிகள் (எதிரயனித் தொகுப்புகள்) மற்றும் நேரயனிகளின் (நேரயனித் தொகுப்புகள்) இணைதிறன்
- ஒரு சேர்மத்தின் அயனி அல்லது அயனித் தொகுப்புகளுடன் இணைந்துள்ள ஹைட்ரஜன் அணுக்களின் எண்ணிக்கை அல்லது ஒற்றை மின்சுமை கொண்ட அணுக்களின் (Na, K, Cl, …..) எண்ணிக்கையே அந்த அயனி அல்லது அயனித் தொகுப்புகளின் இணைதிறன் ஆகும்.
- உதாரணமாக, சல்பியூரிக் அமிலத்தில் (H2SO4) ஒரு சல்பேட் (SO42-) அயனித்தொகுப்புடன் இரண்டு ஹைட்ரஜன் அணுக்கள் இணைந்துள்ளதால் SO42—ன் இணைதிறன் 2.
- அம்மோனியம் குளோரைடில், ஒரு அம்மோனிடம் (NH4+) அயனித் தொகுப்புடன் ஒரு குளோரின் அணு இணைந்துள்ளதால் NH4+ ன் இணைதிறன் 1. சில சேர்மங்களின் நேரயனி, எதிரயனி மற்றும் அவற்றின் இணைதிறன்கள் கீழே கொடுக்கப்பட்டுள்ளன.
எதிரயனிகளின் இணைதிறன்கள்
| சேர்மம் | எதிரயனிகளின் பெயர்கள் | எதிரயனிகளின் வாய்ப்பாடு | எதிரயனிகளின் இணைதிறன் |
| HCl | குளோரைடு | Cl- | 1 |
| H2SO4 | சல்பேட் | SO42- | 2 |
| HNO3 | நைட்ரேட் | NO3– | 1 |
| H2CO3 | கார்பனேட் | CO32- | 2 |
| H3PO4 | பாஸ்பேட் | PO43- | 3 |
| H2O | ஆக்ஸைடு | O2- | 2 |
| H2S | சல்பைடு | S2- | 2 |
| NaOH | ஹைட்ராக்ஸைடு | OH– | 1 |
நேரயனிகளின் இணைதிறன்கள்
| சேர்மம் | நேரயனிகளின் பெயர்கள் | நேரயனிகளின் வாய்ப்பாடு | நேரயனிகளின் இணைதிறன் |
| NaCl | சோடியம் | Na+ | 1 |
| KCl | பொட்டாசியம் | K+ | 1 |
| NH4Cl | அம்மோனியம் | NH4+ | 1 |
| MgCl2 | மெக்னீசியம் | Mg2+ | 2 |
| CaCl2 | கால்சியம் | Ca2+ | 2 |
| Al Cl3 | அலுமினியம் | Al3+ | 3 |
வேதியியல் வாய்ப்பாடு அல்லது மூலக்கூறு வாய்ப்பாடு
வேதியியல் வாய்ப்பாடு என்பது ஒரு குறிப்பிட்ட வேதிச்சேர்மம் அல்லது மூலக்கூறைக் குறிக்கும் எளிய வழிமுறையாகும். இது, ஒரு சேர்மத்தில் இடம்பெற்றுள்ள ஒவ்வொரு மூலக்கூறிலும் உள்ள அணுக்களின் எண்ணிக்கையைக் குறிக்கிறது. ஒரு வேதிச் சேர்மத்தின் வேதியியல் மூறைகள் கீழே விளக்கப்பட்டுள்ளன.
படி 1: நேர் அயனியின் குறியீடு இடது புறத்திலும், எதிர் அயனியின் குறியீடு வலது புறத்திலும் இருக்குமாறு, ஒரு தனிமம் அல்லது அயனியின் குறியீட்டை அருகருகே எழுத வேண்டும்.
படி 2 : அயனிகளின் இணைதிறன்களை தனிமங்களின் குறியீட்டிற்கு மேற்புறத்தில் எழுதவும் (மின்சுமை குறியீடான ‘+’ (அ) ‘-‘ என்பவற்றை எழுதக்கூடாது).
படி 3 : தேவையெனில் இணைதிறன் விகிதங்களைச் சுருக்கி அவற்றின் மிகக் குறைந்த விகிதங்களை எழுதுக. இல்லையெனில் , தனிமம் அல்லது அயனியின் இணைதிறனை இடமாற்றம் செய்க. அந்த விகித எண்களை அடுத்த தனிமத்தின் குறியீட்டிற்கு கீழ்புறத்தில் எழுதவும் (1 என்ற எண்ணை எழுத வேண்டிய அவசியமில்லை). இவ்வாறு வேதிச்சேர்மத்தின் வேதிவாய்ப்பாட்டை எழுதலாம்.
கால்சியம் குளோரைடின் மூலக்கூறு வாய்ப்பாட்டினை எழுதும் முறையினை இப்பொழுது நாம் பார்ப்போம்.
படி 1: கால்சியம் மற்றும் குளோரின் ஆகியவற்றின் குறியீடுகளை எழுதவும்.
Ca Cl
படி 2: அத்தனிமத்தின் குறியீட்டின் மேல் அயனிகளின் இணைதிறனை எழுதவும். Ca2 Cl1
படி 3: தனிமங்களின் இணைதிறன்களை மாற்றி எழுதுக.
Ca Cl2
எனவே, கால்சியம் குளோரைடின் மூலக்கூறு வாய்ப்பாடு CaCl2 ஆகும்.
வேதிச்சேர்மங்களுக்குப் பெயரிடும் முறை
ஒன்றிற்கு மேற்பட்ட தனிமங்கள் வேதிப்பிணைப்பில் ஈடுபட்டு உருவாகக்கூடிய பொருள்களே வேதிச் சேர்மங்கள் ஆகும். இச்சேர்மங்களின் பண்புகள் அவற்றிலுள்ள தனிமங்களின் பண்புகளிலிருந்து மாறுபடுகின்றன. இச்சேர்மங்களுக்குப் பெயரிடும்போது ஒருசில வழிமுறைகள் பின்பற்றப்படுகின்றன. அவை கீழே கொடுக்கப்பட்டுள்ளன.
- உலோகம் மற்றும் அலோகம் ஆகிய இரண்டும் கலந்த சேர்மத்தின் பெயரினை எழுதும்போது உலோகத்தின் பெயரினை எழுதும்போது உலோகத்தின் பெயரினை முதலிலும் அலோகத்தின் பெயரினை அடுத்ததாகவும் எழுதவேண்டும். அலோகத்தின் பெயரிடன் ‘ஐடு’ என்ற பின்னோட்டைச் சேர்த்து எழுதவேண்டும்.
உதாரணம்:
NaCl – சோடியம் குளோரைடு
AgBr – சில்வர் புரோமைடு
- உலோகம், அலோகம் மற்றும் ஆக்சிஜன் கலந்த சேர்மத்தின் பெயரினை எழுதும்போது உலோகத்தின் பெயரினை முதலிலும் அலோகத்தின் பெயரினை அடுத்ததாகவும் எழுதவேண்டும். அலோகத்தின் பெயருடன் ‘ஏட்’ (ate) என்ற பின்னொட்டையோ (அதிக அளவில் ஆக்சிஜன் அணுக்கள் இருந்தால்) அல்லது ‘ஐட்’ (ite) என்ற பின்னொட்டையோ (குறைந்த அளவில் ஆக்சிஜன் அணுக்கள் இருந்தால்) சேர்த்து எழுதவேண்டும்.
உதாரணம்:
Na2SO4 – சோடியம் சல்பேட்
NaNO2 – சோடியம் நைட்ரைட்
- இரு அலோகங்களை மட்டும் கொண்ட சேர்மங்களுக்குப் பெயரிடும் போது அலோகங்களின் பெயருக்கு முன்னொட்டாக மோனோ, டை, டிரை, டெட்ரா, பெண்டா… என்பதைச் சேர்த்து எழுதவேண்டும்.
உதாரணம்:
SO2 – சல்பர் டைஆக்சைடு
N2O5 – டைநைட்ரஜன் பென்டாக்சைடு
வேதிச் சமன்பாடு
வேதிச் சமன்பாடு என்பது ஒரு வேதிவினையை குறியீடுகள் மற்றும் வாய்பாடுகள் வடிவத்தில் எடுத்துக்கூறும் குறியீட்டு முறையாகும். இதில் வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்கள் என இருகூறுகள் உள்ளன. வேதிவினையில் ஈடுபடக்கூடிய பொருள்கள் வினைபடு பொருள்கள் எனவும் அதில் உருவாகக்கூடிய பொருள்கள் வினைவிளை பொருள்கள் எனவும் அழைக்கப்படுகின்றன.
சமன்செய்யப்படாத (முற்றுப்பெறாத) வேதிச்சமன்பாட்டினை எழுதும் முறைகள்
ஒரு வேதிவினையின் சமன்செய்யப்பட்ட சமன்பாட்டினை எழுதுவதற்குமுன் சமன் செய்யப்படாத சமன்பாட்டினை எழுதுவது அவசியம். சமன்செய்யப்படாத சமன்பாட்டினை எழுதும் வழிமுறைகள் கீழே கொடுக்கப்பட்டுள்ளன.
- வினைபடு பொருள்களின் குறியீடுகளை இடப்புறத்தில் எழுதி அவற்றிற்கிடையே கூட்டல் (+) குறியினை இடவேண்டும்.
- அதனையடுத்து அம்புக்குறி () இடவேண்டும். இந்த அம்புக்குறியானது வினையில் ஈடுபடும் பொருள்களையும், உருவாகும் பொருள்களையும் வேறுபடுத்தி அறிய உதவுகிறது.
- அம்புக்குறியின் வலது புறத்தில் உருவாகக் கூடிய பொருள்களின் குறியீடு மற்றும் வாய்பாடு ஆகியவை குறிக்கப்படுகின்றன.
- இப்போது எழுதப்பட்டிருக்கும் சமன்பாடானது சமன்செய்யப்படாத சமன்பாடாகும்.
- வினைவிளைபொருள் வாயுவாக இருந்தால் மேல்நோக்கிய அம்புக்குறியாலும் () விழ்படிவாக இருந்தால் கீழ்நோக்கிய அம்புக்குறியாலும் () குறிக்கப்பட வேண்டும்.
உதாரணம்:
Mg + H2SO4 MgSO4 + H2
வேதிச் சமன்பாட்டை சமன்செய்தல்
- பொருண்மை அழியா விதிப்படி வினைபடு பொருள்களின் மொத்த நிறை வினைவிளை பொருள்களின் மொத்த நிறைக்குச் சமமாக இருக்கவேண்டும். ஒரு சமன்பாட்டின் இருபுறமும் உள்ள தனிமங்களிலுள்ள அணுக்களின் எண்ணிக்கை சமமாக இருந்தால் மட்டுமே நிறையும் சமமாக இருக்கமுடியும்.
- சமன்செய்யப்பட்ட வேதிச்சமன்பாடு என்பது, வினைபடு பொருள்களிலுள்ள தனிமத்தின் அணுக்களையும் வினைவிளை பொருள்களிலுள்ள தனிமத்தின் அணுக்களையும் சமமாகக் கொண்ட சமன்பாடாகும்.
- வேதிச் சமன்பாட்டினை சமன்செய்வதற்கு பலமுறைகள் வழக்கத்தில் உள்ளன. முயன்று தவறுதல் முறை (நேரடி முறை), பின்ன முறை, ஒற்றை, இரட்டை எண்கள் முறை போன்றவை அவற்றுள் சில. ஒரு வேதிச் சமன்பாட்டைச் சமன்செய்யும்போது, கீழ்க்காணும் குறிப்புகளை நினைவில் கொள்ள வேண்டும்.
- சமன் செய்யப்படாத சமன்பாட்டின் இருபுறமும் ஒரு தனிமம் எத்தனை முறை வருகிறது என்பதைக் கணக்கிடலாம்.
- சமன்பாட்டின் இரு பக்கங்களிலும் ஒருமுறை மட்டுமே வரக்கூடிய தனிமத்தினை முதலிலும், இரண்டு முறை வரக்கூடிய தனிமத்தினை அடுத்தும், மூன்று முறை வரக்கூடிய தனிமத்தினை அதற்கடுத்தாற்போலும் சமன் செய்ய வேண்டும்.
- இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்கள் ஒரே எண்ணிக்கையில் இருந்தால் முதலில் உலோகத்தையும் பின்பு அலோகத்தையும் சமன்செய்ய வேண்டும். ஒன்றிற்கு மேற்பட்ட உலோகங்கள் அல்லது அலோகங்கள் இருந்தால் அதிக அணுநிறை உடையவற்றை (அணுநிறையை அறிய தனிமவரிசை அட்டவணையைப் பார்க்கவும்) முதலில் சமன் செய்யவேண்டும்.
- வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்களில் உள்ள மூலக்கூறுகளின் எண்ணிக்கையைக் குறித்துக்கொள்ள வேண்டும்.
- தனிமங்களைச் சமன்செய்யும்போது சேர்மங்களின் மூலக்கூறு வாய்பாட்டினை மாற்றக்கூடாது.
- பின்னங்களைப் பயன்படுத்திச் சமன்செய்தலை ஒரே தனிமத்தின் மூலக்கூறுகளுக்கு (H2, O2, O3, P4) மட்டுமே பயன்படுத்த வேண்டும். அதனை வெவ்வேறு தனிமங்களின் மூலக்கூறுகளுக்குப் (H2O, NH3) பயன்படுத்தக்கூடாது.
நாம் தற்போது ஹைட்ரஜனும் ஆக்சிஜனும் இணைந்து நீர் உருவாகும் வினையினை எடுத்து சமன்செய்வோம்.
படி 1: சமன்பாட்டை வார்த்தைகளால் எழுதவும்.
ஹைட்ரஜன் + ஆக்சிஜன் நீர்
படி 2 : முற்றுப்பெறாத சமன்பாட்டை எழுதவும்.
H2 + O2 H2O
படி 3 : ஒரு சமன்பாட்டின் இருபுறமும் ஒரு தனிமம் எத்தனை முறை வந்துள்ளது என்பதை அடிப்படையாகக் கொண்டு, முதலாவது சமன்செய்ய வேண்டிய தனிமத்தினைத் தேர்வு செய்யவும்.
| தனிமம் | H | O |
| இருபுறமும் உள்ள எண்ணிக்கை | 2 | 2 |
படி 4: இவ்வினையில் இரு தனிமங்களும் ஒரே எண்ணிக்கையில் வருவதால் அதிக அணுநிறை உள்ள தனிமத்தை முதலில் சமன்செய்யவும்.
படி 5: ஆக்சிஜனின் எண்ணிக்கையை சமன் செய்ய வலதுபுறத்தில் H2O க்கு முன் 2ஐச் சேர்க்கவும்.
H2 + O2 2H2O
படி 6: தற்போது ஹைட்ரஜனின் எண்ணிக்கையைச் சமன் செய்ய வினையின் இடதுபுறத்தில் H2 க்கு முன் 2ஐச் சேர்க்கவும்.
2H2 + O2 2H2O
(H = 4, O = 2) (H = 4, O = 2).
படி 7: தற்போது இருபுறமும் 4 ஹைட்ரஜன் அணுக்களும், 2 ஆக்சிஜன் அணுக்களும் உள்ளன.
எனவே, வேதிச் சமன்பாடு சமன் செய்யப்பட்டது.
சமன்செய்யப்பட்ட சமன்பாட்டிலிருந்து கிடைக்கக்கூடிய தகவல்கள்
சமன்செய்யப்பட்ட சமன்பாட்டிலிருந்து நாம் எண்ணிக்கை அடிப்படையிலான மற்றும் தனிக்கூறு சார்ந்த விபரங்களைப் பெறமுடியும். இச்சமன்பாட்டிலிருந்து வினைபடு பொருள்களின் பெயர், குறியீடு மற்றும் மூலக்கூறு வாய்ப்பாடு போன்ற தனிக்கூறு சார்ந்த தகவல்களையும், வினைபடு பொருள் மற்றும் வினைவிளை பொருள்களின் மூலக்கூறுகளின் எண்ணிக்கை போன்ற எண்ணிக்கை தொடர்பான தகவல்களையும் பெறமுடியும். எனினும் வேதிச்சமன்பாட்டிலிருந்து கீழ்க்காணும் தகவல்களைப் பெறமுடியாது.
- வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்களின் இயற்பியல் நிலைமை.
- வேதிவினையுடன் தொடர்புடைய வெப்பநிலை மாற்றங்கள் (வெப்பம் உமிழப்படுவது அல்லது வெப்பம் உட்கவரப்படுவது).
- வேதிவினை நிகழக்கூடிய சூழல்கள் (வெப்பநிலை, அழுத்தம் மற்றும் வினையூக்கி).
- வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்களின் செறிவு (நீர்த்த மற்றும் அடர்).
- வேதிவினையின் வேகம்.
வேதிச்சேர்க்கை விதிகள்
வேதிவினைகளின் பருமனறி அளவீடுகளை உற்றுநோக்கும்போது இவ்வினைகள் அனைத்தும் குறிப்பிட்ட விதிகளுக்கு உட்பட்டு நடக்கின்றன என்பதை அறியலாம். இவ்விதிகளே ‘வேதிச்சேர்க்கை விதிகள்’ ஆகும். அவையாவன:
- பொருண்மை அழியா விதி.
- மாறாவிகித விதி
- பெருக்கல் விகித விதி.
- கே- லூசாக்கின் பருமன் இணைப்பு விதி.
இப்பாடத்தில் முதல் இரண்டு விதிகளைப் பற்றிப் பார்ப்போம்.
பொருண்மை அழியா விதி (நிறை அழிவின்மை விதி)
1774ஆம் ஆண்டு லவாய்சியர் என்ற பிரெஞ்ச் வேதியியலாளர் ஒரு வேதிவினை நிகழும்போது வினைபடு பொருள் மற்றும் வினைவிளை பொருள் ஆகியவற்றின் நிறைகளுக்கு இடையேயான தொடர்பினைப் பற்றிக் கூறினார். இவ்விதிப்படி “ஒரு வேதிவினை நிகழும்போது உருவாகும் வினைவிளைபொருள்களின் மொத்த நிறையானது வினைபடுபொருள்களின் மொத்த நிறைக்குச் சமம்”. மேலும் “ஒரு வேதிவினையின் மூலம் நிறையை ஆக்கவோ, அழிக்கவோ முடியாது” எனவும் பொருண்மை அழியா விதி கூறுகிறது. ஆதலால், இவ்விதியை நிறை அழிவின்மை விதி எனவும் கூறலாம்.
நைட்ரஜன் மற்றும் ஹைட்ரஜனிலிருந்து அம்மோனியா உருவாதல் வினையை நாம் (ஹேபர் முறை) கருதுவோம்.
N2 + 3H2 2NH3
28கி 6கி 34கி
ஹேபர் முறையில் அம்மோனியா உருவாதல் வினை நடைபெறும்போது வினைபடுபொருள்கள் மற்றும் வினைவிளைபொருள்களின் மொத்த நிறையானது தொடர்ந்து சமமாகவே இருக்கும்.
இவற்றிலிருந்து , இயற்பியல் அல்லது வேதியியல் மாற்றத்தின் மூலம் நிறையை ஆக்கவோ அல்லது அழிக்கவோ முடியாது என்பது தெளிவாகிறது. எனவே, ஆற்றல் அழிவின்மை விதி நிரூபிக்கப்படுகிறது.
மாறா விகித விதி
ஜோசப் ப்ரௌஸ்ட் என்ற அறிவியல் அறிஞர் 1779ஆம் ஆண்டு மாறா விகித விதியைக் கூறினார். அவரின் கூற்றுப்படி “ஒன்றுக்கு மேற்பட்ட தனிமங்கள் குறிப்பிட்ட நிறை விகிதத்தில் ஒன்றிணைந்து தூய சேர்மத்தை உருவாக்குகிண்றன”. இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்களைக் கொண்ட சேர்மங்களை அவர் உற்றுநோக்கி, அவை எங்கிருந்து பெறப்பட்டாலும், யார் அதைத் தயார் செய்தாலும், அவை ஒரே விகிதத்தில் தனிமங்களைப் பெற்றுள்ளன எனக் கண்டறிந்தார். உதாரணமாக, பல்வேறு மூலங்களான மழை, கிணறு, கடல், ஆறு ஆகியவற்றிலிருந்து நாம் நீரைப் பெற்றாலும் அதிலுள்ள ஹைட்ரஜன் மற்றும் ஆக்சிஜனின் நிறை எப்பொழுதும் 1 : 8 என்ற விகிதத்தில் இருக்கும். இதேபோல் பல்வேறு சேர்மங்களின் தயாரிப்பு முறை மாறுபட்டாலும், அவற்றிலுள்ள தனிமங்களின் இயைபு மாறாது. அவை குறிப்பிட்ட விகிதத்தில்தான் இருக்கும். எனவே, இந்த விதி மாறாவிகித விதி எனப்படுகிறது.